预防主动脉瓣狭窄致心力衰竭的新治疗靶点
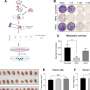
![Cardiomyocyte-specific human β3AR overexpression prevents cardiomyocyte hypertrophy upon catecholamine challenge via NO/cGMP pathway. A Genetic constructs for adeno-associated virus (AAV) vectors encoding hβ3AR and control EGFP. ITR, recognition site for AVV packaging; Cmr4, enhancer sequence; Prom cTnT, troponin T promoter sequence for cardiomyocyte-specific expression; ADRB3, human β3AR receptor cDNA sequence, EGFP enhanced green fluorescent protein sequence, IRES internal ribosome entry site, Luciferase, firefly luciferase sequence; pA, simian virus 40 polyadenylation signal. B Representative images of neonatal rat ventricular myocytes (NRVM) transduced with control (AAV6-EGFP) or human β3AR adeno-associated virus (AAV6-hβ3AR) for 72 h and incubated for 24 h with isoproterenol (10 μM), L-NAME (100 μM) or both. Nucleus is stained in blue with DAPI and α-actin is stained in green to differentiate myocytes from other cells. Scale bar, 60 μm. C Size assessment of NVRM treated as above (40 cells/condition in each preparation; 3 independent preparations). The isoproterenol-induced hypertrophic response is blunted in hβ3AR myocytes and NOS inhibition by L-NAME restores the hypertrophy. D Confocal microscopy images of E9.5 cTnT + / + ;R26ADRB3 tg/tg (control) and cTnT Cre/ + ;R26ADRB3 tg/tg (c-hβ3tg) embryos, showing cardiac expression of GFP in an E9.5 embryo. E Immunoblot showing GFP expression in cardiomyocytes isolated from adult c-hβ3tg mice. F Immunostaining analysis for GFP in cardiac tissue. Scale bar, 50 µm. G β3AR protein levels is increased in c-hβ3tg mice. β3AR density (Bmax) in fmol of [3H]-CGP12177 specifically bound/ mg protein in homogenates from c-hβ3tg (red, n = 3) and WT (black, n = 3) hearts. H Mice with cardiomyocyte-specific overexpression of human β3AR (c-hβ3tg, red) and littermate controls (WT, black) were subjected to transaortic constriction (TAC) surgery (to induce supravalvular AS) or sham surgery and were followed for 2 weeks. I Supravalvular AS was confirmed by echocardiography as an increase in the descendant aortic velocity blood flow. J ATP levels were increased in hearts from c-hβ3tg 2 weeks after supravalvular AS induction ( n = 5/condition). K Cyclic GMP:AMP levels ratio was boosted in hearts from c-hβ3tg mice, thus suggesting an enhancing effect of human β3 overexpression in cardiomyocytes on NO/cGMP signaling ( n = 5/condition). Data are means ± SEM. Mann–Whitney or Student’s t test for non-normally or normally distributed data, and Kruskal–Wallis test with Dunn’s multiple comparisons test. * p p p p Basic Research in Cardiology (2022). DOI: 10.1007/s00395-022-00966-z 预防主动脉瓣狭窄致心力衰竭的新治疗靶点](https://scx1.b-cdn.net/csz/news/800a/2022/a-new-therapeutic-targ.jpg)
国家心血管研究中心(CNIC)的科学家们已经确定了一种新的治疗靶点,用于预防与主动脉狭窄相关的心力衰竭。该研究由Borja博士Ibáñez领导,CNIC临床研究主任,大学医院心脏病学家Fundación Jiménez Díaz,西班牙心血管研究网络(CiberCV)成员。
研究表明,过度表达在心肌β -3细胞肾上腺素能受体β -肾上腺素能系统的成员,可以预防甚至逆转心脏衰竭的小鼠模型主动脉瓣狭窄这种情况目前几乎没有治疗方案。
这项研究发表在心脏病学基础研究“,, CNIC团队采用了一种创新的基因治疗方法是促进这种受体在心脏的表达,从而加强其有益的作用。
“基因疗法在治疗心脏病方面有巨大的潜力。下一步将在心脏与人类更相似的动物(如猪)身上研究这种方法,然后设计一个试点临床试验,将这些有希望的结果转化为患者,”研究合著者、CNIC总干事Valentín Fuster博士解释说。
主动脉瓣狭窄是一种渐进性的主动脉瓣狭窄,主动脉瓣是血液从心脏流向身体其他部位的“闸门”。主动脉瓣的进行性阻塞阻碍了血液向身体器官的供应,并导致心脏内压力的增加。每次心跳排出血液所需的额外力量会产生身体压力,从而恶化心脏心肌.目前的治疗方法是用假体替换受损的瓣膜。
虽然瓣膜置换技术的侵入性已经大大降低,并成功地恢复了瓣膜功能,但Ibáñez博士解释说,经过多年的压力,心肌无法恢复。不幸的是,目前还缺乏能够改善心肌功能的治疗方法,从而缓解长期主动脉狭窄引起的心力衰竭。
除了Ibáñez博士团队领导的CNIC团队外,该研究还得到了意大利和美国团体的输入。这项研究利用了刺激β -3肾上腺素能受体的有益特性,这种受体在脂肪组织和膀胱中大量存在,但在心脏中表达较弱。先前的研究表明,尽管这种受体在心脏中的表达量很低,但刺激它对心脏疾病有潜在的有益影响。
利用培养的大鼠心肌细胞(心肌细胞),研究人员发现,当这些细胞暴露于激素刺激时,β -3肾上腺素能受体的强制表达抑制了这些细胞的肥厚性生长。
通过与由Jose Luis de la Pompa博士领导的CNIC细胞间信号在心血管发育和疾病小组合作,产生了在心肌细胞中过度表达β -3肾上腺素能受体的转基因小鼠。
“当这些小鼠遭受瓣上主动脉狭窄时,它们发展得更少心脏肥大与正常表达水平的小鼠相比,纤维化程度更高。转基因小鼠也没有心力衰竭,它们的心脏代谢效率更高,消耗的葡萄糖更少,”Andrés Pun博士解释道,他是该研究的第一作者。
这些结果促使科学家们研究心肌细胞的线粒体,细胞中的能量生产中心。潘博士说:“因为心肌需要如此高的能量,对线粒体的任何损伤都可能造成灾难性的后果,就像心力衰竭时经常发生的那样。”
在健康的心脏中,线粒体主要燃烧脂肪酸,脂肪酸能高效地产生大量的能量。然而,潘博士说:“衰竭的心脏经常转而使用葡萄糖,这是一种效率低得多的能量来源,这有助于疾病的进展。”
此外,衰竭心脏的线粒体无法有效地融合,因此体积更小,更容易累积损伤。研究人员发现,转基因小鼠的心肌细胞线粒体更大,也更健康。
由于用于开发这些小鼠的转基因技术不适用于患者,研究人员开发了一种基因治疗方法,即将一种无害的病毒注射到小鼠体内,将β -3肾上腺素能受体基因特异性地传递到心肌细胞,从而安全有效地生产受体。
该团队与CNIC病毒载体单位合作,设计了一种无害的病毒,能够进入心肌细胞,并驱动非转基因成年小鼠心脏β -3肾上腺素能受体的表达升高。当这些小鼠遭受主动脉狭窄时,它们与过度表达出生前受体的转基因小鼠一样免受心力衰竭的影响。
在最后的测试中,研究小组将病毒注入非转基因小鼠有长期的主动脉狭窄心脏衰竭.在这些小鼠中,基因治疗诱导的β -3肾上腺素能受体过表达恢复了心脏功能,减少了心肌细胞肥大,恢复了正常的线粒体大小和心脏中线粒体融合蛋白的正常表达,并增加了动物存活率。
更多信息:Andrés Pun-García等人,β -3肾上腺素能受体过表达逆转主动脉狭窄诱导的心力衰竭,恢复平衡的线粒体动力学,心脏病学基础研究“,(2022)。DOI: 10.1007 / s00395 - 022 - 00966 - z