用于骨合成代谢治疗的新适体药物
由香港浸会大学(浸大)领导的一个研究小组已经确定了骨合成代谢治疗的分子靶点,使用一种选定的适体作为硬化蛋白(一种阻止骨骼生长的蛋白质)的抑制剂。这一发现为开发一种有效的治疗骨质疏松症和成骨不全症的新一代治疗方法带来了希望,与已上市的抗体药物相比,这种药物没有心血管风险。
研究结果已发表在期刊上自然通讯而且开展.该新药目前处于临床前试验开发阶段,研究小组计划于2024年在美国和中国大陆开始临床试验。
目前的药物会增加心血管疾病的风险
骨质疏松症是一种代谢疾病,会导致骨密度降低,导致骨骼变弱,更脆弱,更容易骨折。成骨不全症,又称脆性骨病,是一种罕见的先天性遗传疾病,其特征是骨骼极其脆弱。硬化蛋白已被确定为这两种疾病的治疗靶点。
2019年,美国食品和药物管理局(FDA)批准使用抗硬化蛋白单克隆抗体治疗绝经后骨质疏松症。研究还表明,硬化蛋白抗体可增强成骨不全小鼠的骨量和骨强度。
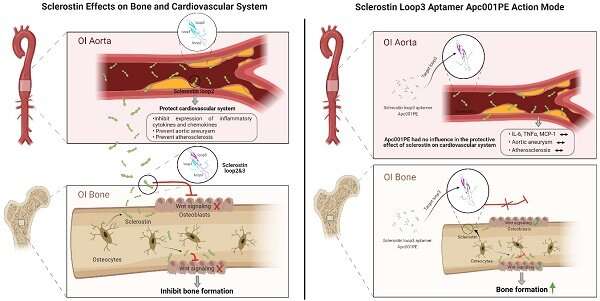
然而,由于硬化蛋白在心血管系统中起着保护作用,人们发现硬化蛋白抗体增加了心脏病发作、中风和心血管死亡的风险临床试验.因此,FDA要求对潜在的心血管风险进行黑框警告。研究小组努力开发替代药物。
loop3被确定为新的治疗靶点
硬化蛋白通过拮抗Wnt信号通路抑制骨形成。Wnt信号通路调节负责骨骼组织再生的干细胞。因此,抑制硬化蛋白促进骨骼生长.
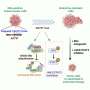
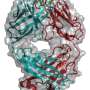
研究小组发现,硬化蛋白核心区的一个loop3结构域可以作为抑制硬化蛋白的分子靶点。通过基因研究研究表明,loop3结构域的缺失可以抑制硬化蛋白对Wnt信号通路的拮抗作用,但不影响硬化蛋白对心血管的保护作用。结果表明,loop3结构域可以作为抑制硬化蛋白的分子靶点,同时保留其心血管保护功能。
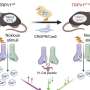
然后,研究人员继续筛选能够特异性抑制硬化蛋白环3的适体。适体是单链DNA或RNA分子,可以选择性地与蛋白质等分子靶标结合。适体与特定蛋白质结合后,可抑制蛋白质-蛋白质相互作用,从而产生一定的治疗作用。通过一种组合技术,一种aptscl56适体被选为一种潜在的硬化蛋白抑制剂,它针对loop3结构。
适体被选为有效和安全的硬化蛋白抑制剂
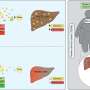
研究小组用骨质疏松大鼠模型和成骨不全小鼠模型检测了aptscl56的治疗功能。他们发现aptscl56能有效促进骨形成。另一方面,在两种模型中,应用aptscl56不会增加发生主动脉瘤和动脉粥样硬化等心血管疾病的风险。
适配体的医学应用具有一定的优势,如热稳定性和易于合成。然而,它们易于快速降解和肾滤过。因此,研究小组对aptscl56进行了修饰,产生了一种半衰期较长的Apc001适体。研究小组证明,Apc001促进骨质疏松大鼠和成骨不全小鼠的骨形成,增加骨量,改善骨微结构完整性,并增强骨力学性能。
临床试验将于2024年开始
“寻找可靠、安全的替代品来克服目前可用药物的局限性,对于帮助需要骨合成代谢疗法的患者至关重要。我们正在进行的研究,从确定硬化蛋白抑制的分子靶点到适配体药物发现为在不久的将来开发下一代硬化蛋白抑制剂带来了希望。”张戈教授说。
“我们正在寻找替代药物骨合成代谢疗法是学术界、产业界和政府三方合作的一个很好的例子。部分研究工作是与本地一间生物科技公司合作进行,并获创新及科技基金资助。一些生物技术公司在内地从事该适体的某些方面的发展研究,例如毒理学测试。的协作工作将继续创造更多合力和丰硕成果。”吕爱平教授说。
治疗适配子Apc001被FDA授予孤儿药称号,用于治疗成骨不全症在2019年。
更多信息:Yu媛媛等,靶向硬化蛋白loop3,保持其心血管保护作用,促进骨形成,自然通讯(2022)。DOI: 10.1038 / s41467 - 022 - 31997 - 8
王璐瑶等,以硬化蛋白环3为靶点的治疗性适体在不增加成骨不全小鼠心血管风险的情况下促进骨形成,开展(2022)。DOI: 10.7150 / thno.63177