囊性纤维化药物可能有助于治疗肺炎
SARS-CoV-2和肺炎球菌等病原体可引起严重肺炎。如果这时气道充满液体,病人就有发展为急性呼吸窘迫综合征的危险。Charité-Universitätsmedizin Berlin的研究人员现在发现了引发肺部积液的分子机制。
这一进展也让他们发现了一种潜在的新疗法:一种囊性纤维化药物在实验室实验中被证明有效,这让人们有希望用于治疗肺炎,而不管引起肺炎的病原体是什么。这项研究已经发表在该杂志上科学转化医学.
肺炎是肺部积液最常见的原因。这种情况被称为肺水肿,导致部分空气空间充满液体而不是空气,这阻止了它们交换气体的工作。病人呼吸困难,身体无法获得足够的氧气。诊断为急性呼吸窘迫综合征,简称ARDS。
“尽管有先进的医疗程序,但大约40%的ARDS患者死于重症监护。问题是抗生素、抗病毒药物和免疫调节疗法很少有足够好的效果,”研究负责人沃尔夫冈·库布勒教授说,他是Charité生理学研究所的所长。“这就是为什么我们在研究中采取了非常不同的方法。我们没有把重点放在病原体上,而是集中在加强肺部血管的屏障功能上。”
这是有道理的,因为它们是肺水肿的液体来源。的肺血管变得可渗透,使血液中的液体流入周围组织,从而使空气充满。
但究竟是什么导致了这种情况呢?什么是潜在的分子机制?Kuebler教授领导的Charité研究小组着手回答这些问题。
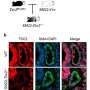
他们用细胞、肺组织和分离的肺进行了实验。这项研究以CFTR为中心氯离子通道科学家们知道,这种物质主要存在于我们呼吸道的粘膜细胞中。在那里,它在保持粘液稀薄方面发挥着重要作用,这样粘液就可以很容易地排出。研究人员现在首次证明,肺部血管中的细胞也有CFTR,并且在肺炎中CFTR的存在大大减少。
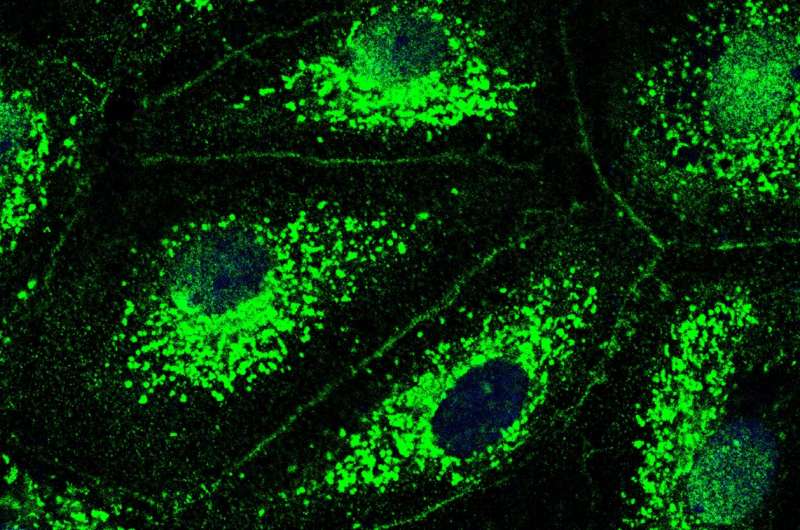
找出CFTR在肺血管中所起的作用以及在分子水平上当氯离子通道丢失时,研究人员用抑制剂堵住通道,并控制细胞中氯离子的数量。然后他们使用了一种被称为免疫荧光成像的特殊成像技术。
“我们发现抑制CFTR引发了一种分子级联,最终导致肺血管开始渗漏,”拉斯提·埃尔菲兰达博士说,他也是生理学研究所的工作人员,也是该研究的主要作者。“所以CFTR实际上在发展中发挥了非常关键的作用肺水肿."
研究结果表明,CFTR的损失导致氯离子在细胞中积聚,因为它停止从细胞中运输出去。过量的氯化物触发信号,最终导致钙通过钙通道不受控制地流入细胞。
“钙浓度的增加会导致血管细胞收缩——就像钙对肌肉细胞的作用一样,”Kuebler教授解释道。“这会导致细胞之间出现间隙,从而使液体从血管中溢出。因此,氯离子通道对于维持肺血管的屏障功能至关重要。”
然后,研究小组提出了另一个问题:它们如何减弱或预防肺炎引起的肺血管中氯通道的丢失?为了回答这个问题,研究人员使用了一种被归类为CFTR调节剂的治疗剂,目前用于治疗囊性纤维化。
在囊性纤维化患者的基因突变会阻止CFTR氯化物通道在气道粘膜细胞中正常工作,导致粘液非常粘稠。“Ivacaftor是一种增加氯通道打开几率的药物,有助于粘液在气道中流动,”Erfinanda医生说。“我们想看看它是否也会对肺部血管中的细胞产生积极影响。”
Ivacaftor确实使氯离子通道更加稳定:与肺部炎症过程通常引起的降解相比,Ivacaftor减少了氯离子通道的降解。在动物模型上的实验也显示了同样的效果:使用ivacaftor治疗增加了严重肺炎的存活概率,减少了肺损伤,并且比不使用该药物治疗的症状要轻得多,总体状况也好得多。
库伯勒教授说:“我们真的没想到它会这么好。”“我们希望我们的发现将为临床试验以测试CFTR调节剂对肺炎患者的疗效。如果这种有前途的、不依赖病原体的治疗方法能够应用到临床实践中,它将使大量患者受益,并防止肺炎危及生命——即使是在病原体未知的情况下。”
Kuebler教授和他的团队目前正在计划研究项目,旨在开发基于CFTR信号通路的其他潜在疗法。他们还将研究哪些患者患ARDS的风险较高,这样他们就可以为这些患者提供预防性的、个性化的治疗。