第一次fda fecal-based治疗有助于对抗超级细菌的抗生素

美国食品和药物管理局周三批准了第一个粪便微生物群治疗,旨在帮助成年人与tough-to-treat (c . diff)梭状芽胞杆菌感染。
“今天批准Rebyota提前在照顾患者复发性梭状芽孢杆菌感染(CDI),”说彼得是博士主任FDA生物制品评价和研究中心。
“复发性CDI影响个体的生活质量,也可能危及生命,“标志着说公司新闻发布。”是美国fda批准的首个粪便微生物群产品,今天的行动代表了一个重要的里程碑,因为它提供了一个额外的批准选项以防止复发CDI。”
在此之前批准,感染治疗使用粪便样本从健康的捐赠者。增加健康的捐赠者肠道的细菌所谓粪便移植有助于对抗收件人的感染。
Rebyota,从出制药公司,还准备从人类粪便。捐助者进行一系列检测传染性病原体,但仍有可能传播感染,FDA说。在一个剂量治疗管理直肠给药。
两个随机、双盲临床研究和一些开放标签临床研究安全性评估批准前,完成涉及共有978名成年人参加。
在一项研究中,最常见的副作用在180 Rebyota接受者相比安慰剂组87腹部疼痛、腹泻、腹胀、气体和恶心。这些病人已经收到一个或多个剂量Rebyota或安慰剂后的24到72小时完成抗生素治疗和控制他们的CDI, FDA说。
FDA评估治疗的有效性通过分析数据从一个随机、双盲、安慰剂对照、多中心研究。
这包括177成年人接受了一剂Rebyota和85年接受一剂安慰剂。分析还注册成功率从不同的安慰剂对照研究中,39岁的成年人收到一剂Rebyota和一剂安慰剂,和另一个43岁的成年人收到两个剂量的安慰剂。
这两项研究的结果,总体成功率在预防复发Rebyota组8周的CDI为70.6%和57.5%安慰剂组。
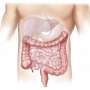
CDI会引起腹泻和显著的结肠炎症。15000年到30000年死于感染与c . diff细菌每年在美国,据美联社报道。
它可以发生在某些情况下服用抗生素后,特别是如果改变肠道微生物,允许c . diff繁殖并释放毒素。65岁以上,住院治疗,免疫功能低下和CDI的先前的历史是危险因素。
更多信息:美国疾病控制和预防中心有更多c . diff感染。
版权©2022每日健康。保留所有权利。