基因疗法为严重癫痫带来了希望

一项研究本月发表在科学的进步麦考瑞大学痴呆症研究中心的一组研究人员发现,他们的治疗方法可以通过清除大脑中蛋白质的积累来预防小鼠癫痫发作。
癫痫是全世界最常见的神经系统疾病,约有7000万人受到影响。三分之二的严重癫痫患者可以用传统药物治疗,但约三分之一的患者不能从任何现有治疗中获益。在某些情况下,当使用标准药物治疗时,癫痫发作会加重。
Dravet综合征是一种严重癫痫,由基因突变引起,始于婴儿期。它可导致每小时多达40次癫痫发作,并与严重的发育迟缓和高死亡率有关。
Lars Ittner教授和他的团队多年来一直在研究神经系统疾病的原因,包括对tau蛋白积累所起作用的广泛研究。
他们最近的一项研究发现,由tau蛋白积聚引起的神经元过度兴奋是阿尔茨海默病进展的关键驱动因素。
过度兴奋的神经元不只是在受到刺激时才会持续放电,会导致癫痫发作、神经网络功能障碍和认知能力下降。
在确定了这种与过度兴奋的联系后,研究小组开始研究除阿尔茨海默氏症之外的其他疾病,其中过度兴奋是一个关键特征,包括癫痫。
Tau蛋白:一个微妙的平衡
大脑微管中过度磷酸化的tau蛋白的积累已被证明与许多神经系统疾病有关,包括各种形式的痴呆症。
当正常工作时,磷酸化过程提供了一个微调功能,允许蛋白质相互通信。在正确的数量和位置,磷酰对维持大脑的信号通路至关重要,但过量会产生毒性作用。
当一个蛋白质分子过度磷酸化,过多的磷基粘附在其表面,改变其形状,削弱其与其他蛋白质结合和通信的能力。磷酸基起到润滑剂的作用,使分子分离并自由漂浮,同时也改变了它们的二级结构,使它们聚集在一起。

伊特纳教授将这一过程比作头发被冲进下水道。排水管可以处理一些毛发,但随着越来越多的毛发堆积,它们会与其他碎屑聚集在一起,最终堵塞管道。
在这种情况下,管道就是人类神经元。一旦被阻断,它就会死亡,并且没有治疗方法可以再生神经元。
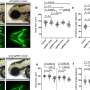
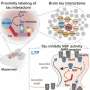
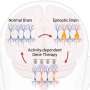
这项新发表的研究由Ittner教授和Janet van Eersel博士团队的二年级博士生Nicolle Morrey领导,研究人员已经证明,相比之下,当tau蛋白在基因组上的特定位置苏氨酸205被激酶p38y磷酸化时,它可以防止兴奋性毒性,从而防止癫痫发作。
“我们可以利用p38y对我们有利,”伊特纳教授说。
“最近,我们设计了一种新的基因治疗载体,并通过引入我们的新疗法通过这种载体,我们已经能够证明,我们只能在需要的地方增加p38y的产量。”
当使用新的基因疗法治疗时,患有不受控制的癫痫的小鼠有更好的生存机会,并且在行为和大脑活动方面表现出明显的改善。
伊特纳教授说:“我们对这种疗法进行了广泛的测试,独立实验室的严格评估证实了我们的结果。”
“我们的下一步是进行更详细的临床前评估,为临床试验做准备。
“作为一种治疗急性神经系统疾病的方法,它显示出巨大的前景,我们希望能够在未来五到七年内,首先为不受控制的癫痫患者提供这种方法。”
支持基因疗法发展
今年早些时候,麦考瑞大学(Macquarie University)成立了一家新公司Celosia Therapeutics,将这项研究和其他突破性的研究转化为商业化的医疗方法。
Celosia Therapeutics获得了麦格理大学超过200万美元的种子基金,独家获得了由Ittner教授和神经生物学和神经化学教授Roger Chung等科学家开发的先进基因疗法专利组合,他们都是各自领域的领导者。
Celosia Therapeutics首席执行官Brenton Hamdorf博士表示,该公司正处于这些有前景的候选疗法的临床前开发阶段,用于治疗不受控制的癫痫和阿尔茨海默病,其他疗法也在研发中。
哈姆多夫博士说:“我们正在开发的疗法都有可能改变这些毁灭性疾病患者的生活。”
“我们与麦考瑞大学和麦考瑞孵化器的合作是将这些治疗方法从实验室带到床边的关键。这些伙伴关系和其他伙伴关系为我们提供了获得关键研究能力、基础设施、临床专业知识和等待这些新治疗方案的患者的重要途径。
“这项研究正处于一个令人兴奋的阶段,我们期待着看到这些疗法能够为患者所用。”