研究人员为食物管癌生成了实验室培养的人体组织模型
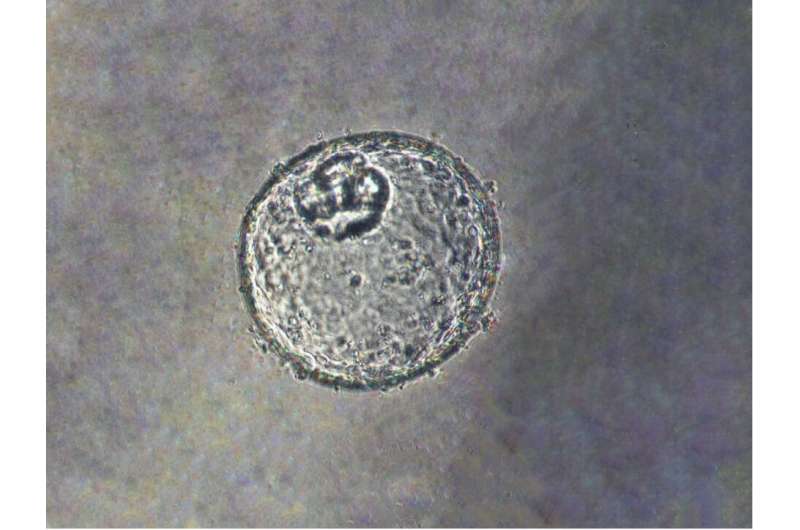
约翰霍普金斯大学医学院的研究人员说,他们已经创建了一个实验室培育的三维“类器官”模型,该模型来源于人体组织,旨在促进对早期癌症如何在胃食道交界处(GEJ)发展的理解,GEJ是消化系统的食物管与胃相遇的地方。
一份关于类器官模型发现的报告,发表于科学转化医学这项研究还揭示了用一种药物治疗GEJ癌症的一个可能的生物学靶点,研究人员已经证明,这种药物可以减缓或阻止小鼠体内这种肿瘤的生长。
根据美国癌症协会的数据,世界范围内每年有超过100万人死于胃食管癌,而GEJ的发病率则更高癌症近几十年来增加了一倍多,从每年50万新增病例增加到100万例。胃酸反流、吸烟和幽门螺杆菌感染是食道和胃部肿瘤的明确危险因素。
但专家表示,很难证明癌症是如何从胃和食道交界处开始的,部分原因是缺乏与gej特异性生物学相关的早期疾病模型进行研究。
“因为我们没有一个独特的模型来区分GEJ肿瘤,胃食管癌通常被归类为两者之一食道癌或胃癌-而不是GEJ癌症,”胃肠病学家Stephen Meltzer医学博士说,他是约翰霍普金斯大学医学院的Harry和Betty Myerberg/Thomas R. Hendrix和美国癌症协会临床医学研究教授,也是这项研究的通讯作者。
“我们的模型不仅有助于识别过程中发生的关键变化肿瘤的生长但也为未来的研究建立了一个策略,以帮助了解其他器官的肿瘤。”
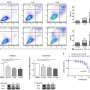
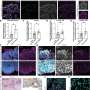
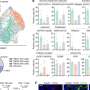
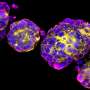
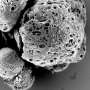
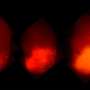
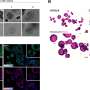
Meltzer和一组专家细胞生物学,表观基因组学、脂质谱和大数据分析通过从接受上窥镜检查的患者身上提取正常的人体活检组织,创建了GEJ疾病模型。类器官包括来自干细胞的三维细胞集合,这些细胞可以复制器官的特征或器官的功能,例如制造特定类型的细胞。
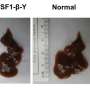
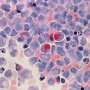
研究人员利用基因编辑技术(CRISPR/Cas9),敲除了类器官中两个关键的肿瘤抑制基因(TP53和CDKN2A)。双重敲除这些基因会导致细胞变得更癌变,生长更快,微观特征更接近恶性肿瘤。这些改变的类器官也在免疫缺陷小鼠中形成肿瘤。
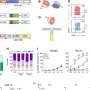
研究小组进一步发现了一类分子(脂类)的异常,这些分子存储能量,但也发挥着各种其他功能,并确定血小板激活因子是GEJ类器官中关键的上调脂类。血小板在血液中循环,当它们识别出受损的血管时,就会结合在一起或凝结,对一些人来说,它们可能导致凝血疾病。
研究人员使用了WEB2086,它可以阻止植入的GEJ类器官肿瘤的生长。WEB2086是美国食品和药物管理局批准的一种用于治疗血小板疾病的化合物,它可以抑制我体内的血小板激活因子受体。
Meltzer说,在将这种化合物用于治疗之前,可能需要更多的临床前研究人类患者但类器官可能有助于推进此类研究。
Meltzer说:“将类器官与这种基因编辑方法[CRISPR/Cas9]结合起来,是研究其他人类肿瘤的一种潜在的富有成效的策略。”
更多信息:赵华等,TP53/CDKN2A双敲除胃食管交界处类器官模型的生成和多组学分析,科学转化医学(2022)。DOI: 10.1126 / scitranslmed.abq6146