新目标对抗胰腺癌
胰腺癌仍是全球最致命的恶性肿瘤之一。因为胰腺导管腺癌的5年生存率(PDAC)只有3%的病人,PDAC全世界很难通过手术治疗。开发新颖的治疗方法,PDAC的生物学在分子水平上需要更好的理解。
在最近的一篇文章中发表癌症科学,研究人员从东京医疗和牙科大学(TMDU)已经确定一个新的目标基因在PDAC情况下具有较强的临床意义。
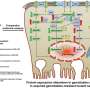
先前的研究已经表明,肿瘤细胞表达高水平的一个特殊enzyme-histone H3K4 methyltransferase-that由SETD1A基因编码。这种酶调节基因表达通过添加甲基化工集团组蛋白蛋白质(染色质的基本结构组成)的特定目标基因通过这一过程被称为甲基化。然而,这种酶的机制导致超表达及其影响癌症细胞尚不清楚。
组蛋白甲基化后,目标基因变得活跃。这一点尤其重要,如果SETD1A目标基因可以支持癌症发展和进展。因此,研究人员从TMDU感兴趣了解PDAC SETD1A进行靶向治疗的作用。
“尽管先前的研究已经表明,SETD1A在各种癌症,如胃癌和肺癌,特定的分子事件PDAC SETD1A并不理解,”第一作者Takeshi Ishii说。“SETD1A目标基因在PDAC还没有确定。”
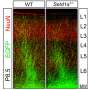
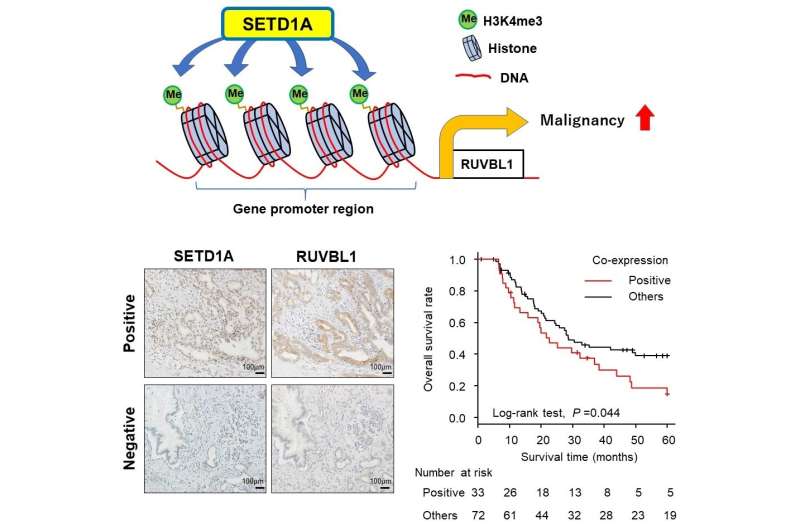
研究人员观察到高水平的SETD1A表达人类PDAC样本分析的51.4%。他们还确定,SETD1A是一个独立的预后因素无病生存,这意味着肿瘤切除后,SETD1A高水平生活在一个无病状态的患者比那些较低SETD1A水平。这些结果表明在PDAC SETD1A表达的临床意义。
然后,他们使用人工培养PDAC细胞检查改变SETD1A表达式将如何影响细胞行为。当他们过表达SETD1A水平,两者兼而有之细胞生长和细胞迁移能力增加。在另一组PDAC细胞,研究人员利用分子技术干扰SETD1A表达式,然后分析了其他基因受此影响。“使用一种称为RNA序列的技术,我们检查整体基因表达后推倒SETD1A,发现另一个基因被称为RUVBL1下级表示,“真嗣田中资深作者解释道。
进一步研究表明,甲醇SETD1A可以RUVBL1附近的组蛋白基因及其基因表达激活。推倒RUVBL1 PDAC细胞表达之前所观察到的类似的生物效应与SETD1A干扰。”患者的生存率分析显示PDAC高SETD1A和RUVBL1水平总体存活率较差,表明他们co-expression是一个重要的预后生物标志物的癌症,”Takeshi Ishii说。
研究结果提供更深入的洞察PDAC SETD1A和RUVBL1表达的意义和可能与关键的治疗决策提供关键细节,帮助临床医生对病人患有严重的疾病。
更多信息:武Ishii et al,小说的目标的识别SETD1A组蛋白甲基转移酶和胰腺癌的临床意义,癌症科学(2022)。DOI: 10.1111 / cas.15615