癌症免疫疗法的副作用风险与基因有关

即使它们已经彻底改变了癌症治疗,免疫检查点抑制剂也会产生一系列与免疫相关的不良副作用。在一项新的研究中,达纳-法伯癌症研究所的科学家们首次确定了使患者处于这些并发症高风险的遗传基因变异。
这一发现发表在今天的杂志网络版上自然医学该研究采用了一个数学模型,使研究人员在分析方面取得了非凡的飞跃:利用肿瘤组织中与癌症相关的突变数据,研究人员能够推断出患者基因遗传的特征。他们发现,患有特定生殖系变异(常见的基因遗传改变)的患者在checkpoint抑制剂治疗中出现自身免疫样副作用的可能性增加。
该研究的作者说,通过在治疗前识别这些患者——使用许多美国癌症中心已经提供的模型和肿瘤分析技术——医生可能能够修改治疗方案,以最大限度地减少副作用。
“免疫检查点抑制剂在各种癌症类型中都非常有效,但患者经常经历免疫相关的毒性,其中一些可能相当严重,”丹娜-法伯,麻省理工学院和哈佛大学布罗德研究所和布里格姆妇女医院的联合资深作者亚历山大·古瑟夫博士说。
“识别毒性高风险患者的努力主要集中在肿瘤组织的遗传方面。我们在这项研究中的假设是,患者的生殖系遗传影响发生这些毒性的风险。”
大约20%接受检查点抑制剂治疗的患者会发展为中度至严重的副作用-这一数字与所有获批治疗的癌症类型一致。副作用反映了与自身免疫性疾病:皮肤问题、疲劳、关节疼痛、反复发烧、结肠炎,严重者还有心肌炎、心肌炎症。
这些症状是免疫系统过度攻击的结果。检查点抑制剂通过降低免疫系统攻击的障碍来发挥作用癌症细胞但由于正常细胞也部署了一些相同的屏障,它们也可能受到攻击。
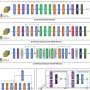
为了了解患者的生殖细胞dna(细胞内的遗传物质)是否掌握他们对此类事件易感性的线索,研究人员进行了一项研究全基因组关联研究(GWAS)对1,715名接受检查点抑制剂治疗的12种癌症类型的患者进行了研究。GWASs对基因组进行扫描,以确定人与人之间经常不同的部分是否与某种特定疾病有关。
通常情况下,这涉及到一种技术,它可以按顺序读取患者DNA中的每个字母正常细胞(通常是血细胞)。然而,在这项新研究中,Gusev和他的同事们设计了一种方法,利用患者肿瘤组织基因组分析中已有的数据进行GWAS研究。
作为丹娜-法伯医学中心“档案”项目的一部分,研究人员对1715名患者的肿瘤组织进行了扫描,以寻找约500个与癌症相关的基因突变。虽然这有助于识别这些肿瘤的遗传脆弱性,但它并没有耗尽为每个肿瘤收集的基因组数据。古谢夫创建了一个数学模型它使用来自Profile的原始数据来生成患者基因组的读数,并识别其中的任何变异。
Gusev说:“我们从肿瘤的500个靶向基因发展到这组患者的全基因组常见变异。”
掌握了基因组数据后,研究人员分析了患者的医疗记录,看看那些服用检查点抑制剂产生中度至严重副作用的患者是否携带任何常见的基因组变异。他们发现了三种这样的变异,其中最突出的是在IL7基因附近。随后,他们在马萨诸塞州总医院接受治疗的196名患者和参加检查点抑制剂atezolizumab临床试验的2275名患者中证实了这些发现。
“在我们最初的患者队列中,我们发现在IL7附近有基因组改变的患者中,检查点抑制剂相关毒性的发生率高出三倍,”该研究的共同高级作者、丹娜-法伯的Toni Choueiri医学博士说。“在另外两组患者中,IL7组的毒性率高出5倍。”
“众所周知,IL7基因有助于稳定淋巴细胞(有助于对抗疾病的白细胞),”丹娜-法伯的马修·弗里德曼医学博士指出,他也是该研究的共同高级作者。研究人员发现,携带IL7种系变异的患者在检查点抑制剂治疗期间和治疗后的淋巴细胞稳定性更好,这种稳定性与不良事件的高风险和生存率的提高有关。
研究人员说,稳定、活跃的淋巴细胞既可能导致类似自身免疫的副作用,也可能对肿瘤产生更猛烈的攻击,从而延长患者的生存期,这在生物学上是有意义的。
这项研究提供了第一个证据,证明遗传基因变异可能是检查点抑制剂治疗免疫相关副作用易感性增加的标志。该研究的作者说,这一发现可能最终有助于肿瘤学家进一步为患者进行个性化治疗:那些可能出现严重副作用的患者可能会被建议进行强度较低或疗程较短的治疗,而那些毒性风险较低的患者可能会受益于更高剂量或更积极的治疗。