研究发现三联免疫疗法可能治疗胰腺癌
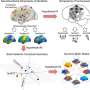
德克萨斯大学MD安德森癌症中心的研究人员发现了一种新的免疫治疗组合,靶向T细胞和骨髓抑制细胞中的检查点,成功地重新编程了肿瘤免疫微环境(TIME),并显著改善了胰腺癌临床前模型中的抗肿瘤反应。
这项研究今天发表在自然癌症在美国,研究人员对小鼠和人类胰腺癌进行了全面的免疫分析,以系统地确定其机制免疫疗法抵抗和调查潜在的治疗靶点.他们发现,中和时代的几种不同的免疫抑制机制显著改善存活率在实验室模型中,这为这种臭名昭著的致命和无反应的疾病提供了一种潜在的治疗方案癌症.
“在我们的模型中,这种三联疗法导致了前所未有的疗效反应,”通讯作者、癌症生物学教授Ronald DePinho博士说。“普遍的观点是,胰腺癌对免疫治疗无效,但这临床前研究这表明正确的联合治疗很容易导致这种疾病。此外,这些靶点在人类胰腺癌标本中的存在,提出了一种令人兴奋的可能性,即这种治疗组合有朝一日可以帮助我们的患者。”
胰腺癌是美国癌症死亡的主要原因之一,部分原因是80%的病例是在晚期被诊断出来的。胰腺癌也被认为是“非免疫原性的”,这意味着它对常用的抗pd -1和抗ctla -4免疫检查点抑制剂无反应。这在一定程度上是由于《时代》杂志中的免疫抑制条件,但这种耐药性背后的机制尚不完全清楚。
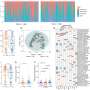
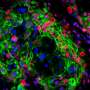
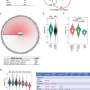
研究人员使用高维免疫谱分析和单细胞RNA测序来研究各种免疫疗法对TIME的影响。他们发现了特定的免疫检查点蛋白41BB和LAG,它们在耗尽的T细胞中高度表达。
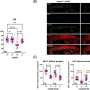
在测试针对这些检查点的抗体时,研究人员观察到,使用41BB激动剂和LAG3拮抗剂联合治疗的模型速度较慢肿瘤与单独使用抗体或其他检查点抑制剂治疗相比,进展、更高水平的抗肿瘤免疫指标和显著提高的生存率。值得注意的是,这些临床前研究忠实地反映了抗pd1或抗ctla -4治疗缺乏疗效的人类数据。
研究人员还证实,这两个治疗靶点存在于人类胰腺癌样本中,分别有81%和93%的患者携带41BB和LAG3表达的T细胞。
由于这种双重治疗组合并没有完全消除已建立的肿瘤,研究人员还检查了重新编程TIME以进一步使肿瘤对免疫治疗敏感的努力。在基线时,TIME含有大量表达CXCR2的髓源性抑制细胞(MDSCs), CXCR2是一种与招募免疫抑制细胞相关的蛋白质。仅抑制CXCR2可减少MDSC迁移并阻止肿瘤生长,但不能治愈。这促使研究人员考虑针对41BB、LAG3和CXCR2的组合。
在90%的临床前模型中,正是这三种组合导致了肿瘤的完全消退和总生存率的提高。在一个更严格的实验室模型中,该组合在超过20%的病例中实现了肿瘤完全消退。
“这些结果令人鼓舞,特别是考虑到艾滋病患者缺乏有效的免疫治疗方案胰腺癌德平尼奥说。“通过靶向多种阻碍免疫反应的协同机制,我们可以给T细胞一个攻击这些肿瘤的战斗机会。当然,我们仍然需要看看这种组合如何在临床中转化为安全有效的治疗方案,我们邀请其他研究人员在这些结果的基础上进行研究。我们乐观地认为,胰腺癌,以及其他非免疫源性癌症,最终可以通过联合免疫治疗变得脆弱。”
作者指出,这些特殊的免疫疗法目前正在进行中临床试验作为单一疗法,这表明有可能迅速将这种三重组合转化为临床研究.