通过细胞因子标记的T细胞增强癌症免疫治疗
近年来出现了一波过继细胞疗法(ACTs),这是一种免疫疗法,从患者身上获得T细胞(T细胞转移疗法)和其他免疫细胞,在体外激活和繁殖,并将大量的T细胞注入血液循环,以帮助对抗癌症。
在被称为CAR-T细胞疗法的ACT的成功版本中,免疫肿瘤学家,此外,基因工程嵌合抗原受体(CAR)转化为T细胞,它的一个部分结合一种特定的肿瘤细胞类型,另一个部分帮助释放T细胞的肿瘤细胞破坏活性。
CAR-T细胞疗法已经发展到临床实践,用于治疗免疫系统肿瘤,如白血病和淋巴瘤,以及最近的多发性骨髓瘤白细胞在骨髓中。然而,T细胞转移疗法尚未成功应用于实体肿瘤因为T细胞不容易穿透实体肿瘤肿块并在其中存活足够长的时间,而且它们的活性被免疫抑制肿瘤微环境所抑制。
克服这些限制的一种方法可能是将T细胞转移疗法与细胞因子疗法配对。细胞因子是由某些免疫细胞分泌的小蛋白质,可以增强其他免疫细胞(包括转移的T细胞)的肿瘤破坏活性。然而,这种方法的一个严重缺点是细胞因子在体内自由循环产生的显著副作用,导致毒性和潜在的致命炎症综合征。此外,尽管全身注射细胞因子会带来风险,但它们往往被清除得太快,无法产生预期的癌症治疗效果。
现在,哈佛大学Wyss生物工程研究所、哈佛大学John a . Paulson工程与应用科学学院(SEAS)和Dana-Farber癌症研究所(DFCI)的一项研究合作开发了一种纳米技术驱动的解决方案。该方法利用了一种非天然糖,它被吸收并整合到T细胞的外部涂层中,然后可以用来锚定细胞因子。
浓缩的细胞因子局部增强T细胞功能而不产生不必要的全身副作用。在患有黑素瘤(一种侵袭性实体瘤类型)的小鼠中,这种方法也刺激了宿主的免疫系统肿瘤细胞,抑制肿瘤生长。作为CAR-T细胞疗法的附加疗法,它可以使淋巴瘤肿瘤在其他非治愈性细胞剂量下完全消退。研究结果发表在美国国家科学院院刊.
资深作者David Mooney博士说:“我们看到的结果表明,朝着开发对实体瘤有效的ACTs和对各种血癌更有效的ACTs迈出了重要一步。”他是Wyss研究所创始核心成员,也是哈佛大学约翰·保尔森工程与应用科学学院罗伯特·p·平卡斯家族生物工程教授。“我们的方法可以很容易地扩展,并与目前用于制造治疗性T细胞(包括CAR-T细胞)的工艺集成,因此可以在相对较短的时间内应用于临床。”
Mooney将他们的生物工程专业知识与癌症免疫学家Kai Wucherpfennig医学博士结合起来。Wucherpfennig是DFCI癌症免疫治疗研究中心主任,布里格姆和哈佛医学院神经生物学教授,以及麻省理工学院和哈佛大学布罗德研究所的副成员。
糖加上细胞因子等于增强T细胞疗法
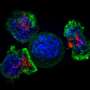
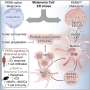
能够追踪癌症反应性树突状细胞,它们在人体中协调更广泛的免疫反应淋巴结穆尼的团队之前开发了一种基于生物材料的方法,允许他们将细胞吸引到活体动物的三维支架上,在那里他们采用一种合成的活性糖分子,并将其用作细胞表面复杂糖链的构建单元。
“在我们的新研究中,我们同样利用了细胞的天然糖代谢,但通过培养皿中的纳米颗粒将活性叠氮糖传递给T细胞。细胞的糖代谢利用糖,并通过代谢将其整合到细胞表面的复杂糖链中,”第一作者刘宇彤说,他是与穆尼合作的研究生。
“在第二步中,使用点击化学,我们利用糖分子的叠氮基将特定的细胞因子分子与它们连接起来,这些细胞因子分子被高度兼容的化学基团[DBCO]修饰。只需将含糖纳米颗粒和细胞因子添加到培养基中,使该方法极其简单,与过继细胞制造管道完全兼容。”
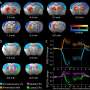
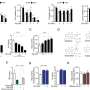
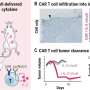
在优化了培养T细胞中细胞因子的结合过程,并确保细胞的活力和一般功能不受影响后,研究小组在患有实体黑素瘤的小鼠身上测试了他们的方法。他们发现,携带抗肿瘤细胞因子白介素-12 (IL-12)的黑素瘤特异性T细胞在非治疗性细胞剂量下显著延缓了肿瘤的生长,并将动物的寿命延长了50%。相比之下,同样数量的黑色素瘤特异性T细胞过继转移与全身注射IL-12产生的效果要弱得多。
过继转移的T细胞也具有更好的生存能力,并在动物体内分化为肿瘤破坏细胞,并涉及其他T细胞类型和免疫细胞在对抗肿瘤的更广泛的免疫反应中发挥作用Liu说:“我们发现,与对照条件相比,在解剖肿瘤和动物脾脏中,接受与IL-12结合的黑色素瘤特异性代谢标记T细胞的动物,辅助T细胞和细胞毒性T细胞的增加要大得多,并且有明显的迹象表明,这些细胞增加了肿瘤特异性活性。”
研究人员认为部分原因可能是树突状细胞(dc)是更广泛的肿瘤定向免疫反应的关键协调者,与不含IL-12的T细胞相比,具有偶联IL-12的黑色素瘤特异性T细胞更强烈地刺激树突状细胞。
“我们认为我们的方法可以增强肿瘤特异性免疫周期。首先,过养转移的il -12偶联T细胞分化并杀死肿瘤细胞子集,导致释放不同的肿瘤特异性抗原,这些抗原被dc吸收并处理,dc将它们呈现给附近淋巴结中的其他肿瘤特异性T细胞,然后这些T细胞也入侵肿瘤,直接促进肿瘤细胞的杀伤和更多抗原的扩散,”Liu假设道。
该团队观察到的抗原扩散效应可能与实体瘤的治疗非常相关,实体瘤通常具有高度异质性的细胞组成,因此更难通过靶向一种抗原来攻击。
在他们研究的最后一部分,研究人员将他们的T细胞方法用于小鼠异种移植淋巴瘤模型的CAR-T细胞治疗。含有偶联IL-12的代谢标记CAR-T细胞能够控制肿瘤的发展,延长之前注射淋巴瘤细胞的小鼠的生存,并且在缺乏IL-12的CAR-T细胞无法治愈动物的剂量下。
“癌症免疫治疗新方法的直接和优雅的性质为癌症患者提供了巨大的潜力。我们很高兴通过Wyss研究所的高优先级验证项目计划来支持这一努力,这将有望加速其向临床的发展,”Wyss创始董事Donald Ingber医学博士说,他也是哈佛医学院和波士顿儿童医院的Judah Folkman血管生物学教授,以及SEAS生物激励工程Hansjörg Wyss教授。