美国批准治疗阿尔茨海默病的新药

美国食品和药物管理局(fda)周五批准了一种备受期待的新药,旨在减缓轻度和早期阿尔茨海默病患者的认知能力下降。
就在FDA批准这种名为Leqembi(又名lecanemab)的药物的几天前,该监管机构在一份国会报告中因批准另一种阿尔茨海默病药物Aduhelm而受到严厉批评。
尽管试验结果显示单克隆抗体治疗有脑肿胀和出血的风险,但它还是被批准了。
这两种药物都是通过一个加速程序获得批准的,该程序允许FDA快速批准药物,用于医疗需求未得到满足的严重疾病。
Leqembi和Aduhelm由日本卫材(Eisai)和美国百健(Biogen)联合开发,FDA在一份声明中表示,这两种药物“代表了有效治疗阿尔茨海默病的持续斗争中的重要进展”。
FDA药物评估和研究中心的比利·邓恩在一份声明中说:“阿尔茨海默病会极大地削弱患者的生活能力,并对他们的亲人产生毁灭性的影响。”
Dunn说,Leqembi是“针对并影响阿尔茨海默氏症潜在疾病过程的最新疗法,而不仅仅是治疗疾病的症状。”
大约有650万美国人患有阿尔茨海默氏症,其特征是记忆丧失和精神敏锐度下降。
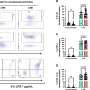
今年9月公布的Leqembi试验的初步数据发现,它将阿尔茨海默病患者的认知能力下降速度降低了27%。
第三阶段试验涉及近1800人,分为服用药物和服用安慰剂的两组,试验持续了18个月。
完整的试验数据,发表在新英格兰医学杂志,引起了人们对脑出血和肿胀等“不良反应”发生率的担忧。
结果显示,服用该药物的患者中有17.3%的人出现脑出血,而服用安慰剂的患者中这一比例为9%。

服用该药物的人中有12.6%的人出现了脑肿胀,而安慰剂组的这一比例仅为1.7%。
在该药物的两组试验中,报告的死亡率几乎相同。
每年26500美元
在阿尔茨海默病中,两种关键的蛋白质,tau蛋白和β淀粉样蛋白,会堆积成缠结和斑块,一起被称为聚集物,导致脑细胞死亡,导致大脑萎缩。
Leqembi每两周静脉注射一次,通过靶向淀粉样蛋白起作用。
在试验中,与安慰剂组相比,接受Leqembi治疗的患者大脑淀粉样蛋白斑块有统计学意义上的显著减少,而安慰剂组的β淀粉样蛋白斑块没有减少。
Biogen和Eisai之前曾将Aduhelm推向市场,但它是否有效存在重大争议,2021年批准Aduhelm导致FDA三名高层辞职。
美国国会的一项调查称,Aduhelm的加速审批过程“充斥着违规行为”,并对fda和百健都提出了批评。Aduhelm是数十年来首个获批治疗阿尔茨海默症的药物。
国会报告称,总部位于马萨诸塞州剑桥的Biogen为Aduhelm设定了“不合理的高价”,每年56,000美元。
卫材表示,Leqembi最初的定价为每年2.65万美元,预计3年后将有10万美国人接受这种药物。
阿尔茨海默氏症协会总裁兼首席执行官Joanne Pike对Leqembi的批准表示欢迎,但她担心其高昂的成本可能会使大多数美国人负担不起,特别是如果它不在老年医疗保险计划的覆盖范围内。
派克在一份声明中说:“如今,患有这种致命疾病的人没有时间等待神奇的药物或治疗方法。”
©2023法新社