研究人员识别关键蛋白调节低密度脂蛋白胆固醇的分子机制
至关重要的一步理解的机制参与心血管疾病和某些癌症,领导的一个加拿大研究小组已经成功的世界第一:他们发现的蛋白质的分子机制PCSK9降低低密度脂蛋白的受体,最富有的在血液中胆固醇颗粒。
纳比尔·g·Seidah发现,生化神经内分泌学研究中心主任蒙特利尔临床研究所和蒙特利尔大学医学教授发表在一月的问题分子代谢。
他的工作与合作完成的卡罗尔Fruchart盖拉德Paris-Saclay大学和他的同事们在药物和卫生技术,以及药学部门比萨大学的科学家,在意大利。
低密度脂蛋白、低密度脂蛋白血液中可以累积,导致动脉粥样硬化和心脏病。低密度脂蛋白和胆固醇水平与之关联(年龄组),直接调制能力的低密度脂蛋白受体(LDLR)收集血液中的低密度脂蛋白和内化,主要为肝细胞。表面LDLR驱动器低密度脂蛋白进入细胞捕获,LDLR返回到表面,另一轮的捕捉。
罕见的情况下与PCSK9的蛋白质
大多数情况下,家族性高胆固醇血症的LDLR功能障碍有关。但少见病例与PCSK9蛋白质,Seidah的实验室在2003年发现的。PCSK9也出现在血液中,同事LDLR,促进肝细胞的退化,防止回到表面捕捉低密度脂蛋白。一些hypercholesterolemic患者有一个“超级PCSK9”,提高LDLR的退化。
近年来,高度有效的治疗方法已用于病人抑制函数(称为单克隆抗体)或减少(称为RNAi) PCSK9的血液中,导致大量的LDLR确保年龄组下降超过60%相比,传统的他汀类药物。
现在Seidah和他的团队的工作电梯前面的面纱误解机制PCSK9拖LDLR向溶酶体,降解,细胞PCSK9-LDLR复杂。
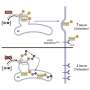
一个复杂的蛋白质三个伙伴
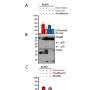
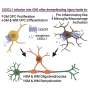
在他们的实验室里,Seidah和他的研究小组进行了结构分析,揭示了形成复杂的三个PCSK9的伴侣蛋白,包括LDLR, CAP1 HLA-C。
一个关键的蛋白质免疫系统,发现HLA-C发挥重要作用:它将整个复杂的溶酶体。HLA-C允许识别“自我”,并刺激T淋巴细胞的抗肿瘤活性。
PCSK9,就其本身而言,有助于防止肿瘤的生长和转移通过增加相关HLA-C在细胞表面的水平。
最终,希望可以开发抑制剂,防止PCSK9的交互和HLA-C块LDLR和HLA-C PCSK9的功能。
,可以应用于突破临床实践治疗心血管疾病以及各种类型的癌症和转移的病人。
“PCSK9的分子相互作用抑制nanobody, CAP1 HLA-C:功能性LDLR的监管水平,“Nabil Seidah et al,发表在一月份的分子代谢。
更多信息:卡罗尔Fruchart盖拉德et al, PCSK9的分子相互作用抑制nanobody, CAP1 HLA-C:功能性监管LDLR的水平,分子代谢(2022)。DOI: 10.1016 / j.molmet.2022.101662