研究结果显示,结合疗法在三分之一的耐药卵巢癌患者中产生缓解
在Dana-Farber领导的一项国际临床试验中,涉及对铂治疗耐药的复发性卵巢癌患者,一种名为mirvetuximab soravtansine的新型结合疗法比标准疗法的反应要好得多。Mirvetuximab soravtansine于2022年11月获得美国食品和药物管理局(FDA)的加速批准。
FDA的批准是基于SORAYA研究的结果,该研究于1月30日发表在《美国医学杂志》上临床肿瘤学杂志之前在妇科肿瘤学会有过报道年度会议2022年3月和2022年6月的美国临床肿瘤学会年度会议。
“SORAYA研究的结果支持FDA加速批准mirvetuximab用于复发性、铂耐药、叶酸受体α阳性卵巢患者癌症Ursula A. Matulonis医学博士,Dana-Farber妇科肿瘤科主任,该研究的主要作者和联合首席研究员。
FDA最近批准了这种药物,使其成为2014年以来首个被批准的铂耐药卵巢癌治疗方法,我们今天在《美国医学杂志》上报道了这一发现临床肿瘤学杂志强调mirvetuximab soravtansine对这一患者群体的益处。”
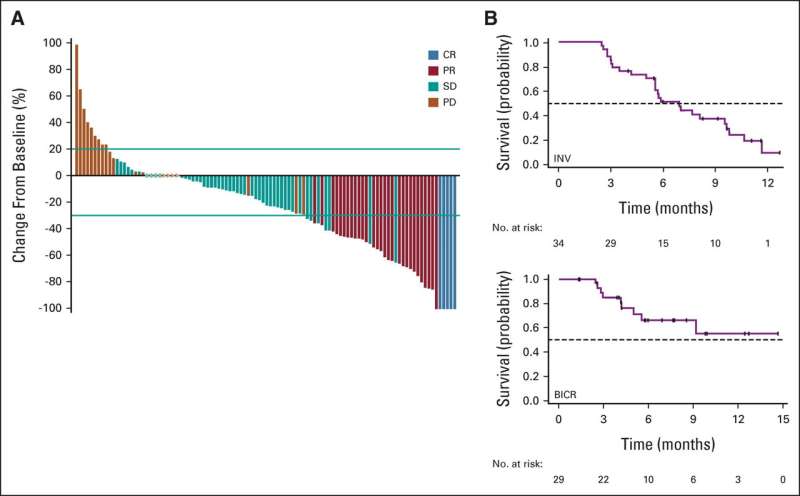
该研究招募了106例高表达叶酸受体α的铂耐药高级别浆液性卵巢癌患者。参与者之前已经接受了三次治疗卵巢癌.
研究结果显示,在中位随访13.4个月后,32.4%的参与者有客观的抗癌反应,其中5人有完全反应,或所有癌症症状消失。中位缓解持续时间为6.9个月。
重要的是,观察到的药物活性与先前接受贝伐单抗治疗的患者之前接受的治疗线或PARP抑制剂暴露的数量无关。研究参与者对Mirvetuximab耐受良好。与治疗相关的最常见的不良副作用是视力模糊、角膜病变(一种眼睛的非炎症性疾病)和恶心。
这种新型药物是越来越多的抗体-药物偶联物(adc)中的一种,adc由一种药物与一种直接针对癌细胞的抗体相连组成。Mirvetuximab将针对高级别浆液性卵巢癌的叶酸受体α分子的抗体连接到一种名为DM4的药物分子,这种药物分子可以破坏微管的形成。(微管是细胞骨架的主要组成部分,赋予细胞形状和结构。)叶酸受体蛋白在某些肿瘤细胞中的含量远高于正常细胞,使其成为抗癌药物的一个有吸引力的靶点。
更多信息:Ursula A. Matulonis等人,Mirvetuximab Soravtansine对铂耐药卵巢癌患者叶酸受体α高表达的有效性和安全性:来自SORAYA研究的结果,临床肿瘤学杂志(2023)。DOI: 10.1200 / JCO.22.01900