新的研究为脓毒症提供了一个有希望的治疗靶点
脓毒症是重症监护室中最急性和最严重的疾病并发症之一,由各种感染引起,并导致危及生命的器官功能障碍。肠屏障在脓毒症的发生过程中起着至关重要的作用,其破坏加剧了脓毒症的发生。
一项新的研究美国病理学杂志免疫抑制剂雷帕霉素促进自噬(细胞分解和破坏受损或异常蛋白质的过程)是否能减少肠上皮细胞死亡并恢复肠屏障功能脓毒症.
该研究还表明,哺乳动物自噬负调节因子雷帕霉素靶蛋白(mTOR)与球样激酶1 (PLK1)的相互作用在脓毒症诱导的屏障功能障碍中至关重要,可能为脓毒症的治疗提供新的见解。
首席研究员吕伟华说:“尽管人们对败血症病理生理学的了解越来越多,先进的临床治疗方法也得到了应用,但败血症仍然是全球健康损失的主要原因,与健康相关的负担很高。”
“由于mTOR和PLK1在败血症中的作用尚不清楚,因此有必要进行进一步的研究。”
在这项研究中,老鼠进行盲肠结扎和穿刺(CLP),穿孔盲肠允许排泄物释放到腹膜腔,从而建立体内脓毒症模型。
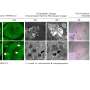
与假手术组相比,CLP小鼠肠粘膜损伤严重,肠粘膜通透性增加。在雷帕霉素治疗下,自噬的激活抑制了肠细胞凋亡,恢复了被破坏的肠屏障,提示自噬在脓毒症诱导的肠屏障功能障碍中起保护作用。
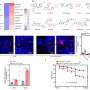
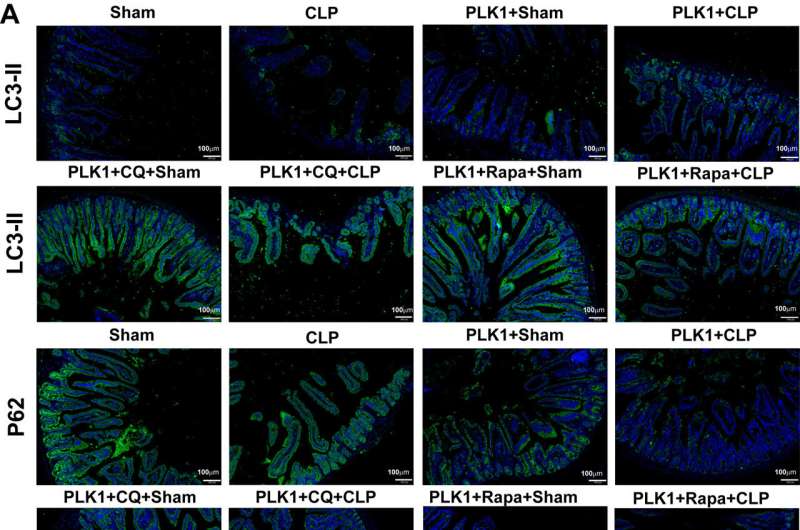
为了确定PLK的保护作用是否依赖于自噬,用PLK1基因修饰的小鼠(CAG-PLK1小鼠)进行了CLP。细胞自噬激活,凋亡减轻。然而,与用雷帕霉素治疗的小鼠相比,用自噬抑制剂氯喹治疗的小鼠的这些改善现象恶化了。这些结果表明,PLK1通过促进肠道自噬来预防败血症诱导的屏障功能障碍。
为了进一步探索PLK1是否通过mTOR通路促进自噬肠上皮细胞,研究人员在体外人结肠上皮细胞模型中观察到PLK1和mTOR之间的物理相互作用。他们发现PLK1还促进细胞自噬并改善自噬而且渗透性高。此外,PLK1在脓毒症期间与mTOR发生物理相互作用,并参与肠细胞的相互调节串扰。
“PLK1-mTOR轴的相互调节在脓毒症诱导的肠屏障功能障碍中至关重要,”Lu博士说。“这些发现表明,PLK1-mTOR轴可能是治疗败血症的一个有前途的治疗靶点。”
更多信息:曹颖雅等,Rapamycin轴的Polo-Like Kinase 1-Mammalian Target of Rapamycin轴调节自噬抑制脓毒症患者肠屏障功能障碍,美国病理学杂志(2022)。DOI: 10.1016 / j.ajpath.2022.11.008