研究人员发现了肿瘤进化的新方面和治疗的潜在靶点
路德维希癌症研究所的一项研究发现,免疫系统对癌症的监测本身可以诱导早期肿瘤细胞的代谢适应,同时促进它们的生长,并使它们能够抑制致命的免疫反应。
由路德维希洛桑协理委员何平志领导,发表于细胞代谢这项研究详细阐述了在小鼠皮肤模型中发生突发性肿瘤的“免疫代谢编辑”的精确机制癌症黑色素瘤,并确定了一个新的生化信号级联和蛋白质,编排其影响。除了阐明先前未知的肿瘤进化维度外,这些发现还为提高癌症免疫治疗的疗效提供了重要的希望。
Ho说:“我们已经发现了数十种有助于黑色素瘤免疫逃避的代谢酶。”“这些酶,以及我们已经确定的信号通路的一些单独成分,代表了一个丰富的潜在药物靶点,可以破坏免疫代谢编辑建立的防御。这些药物可能会使肿瘤更容易受到免疫清除,也可以与检查点封锁和其他免疫疗法联合使用,以克服大多数癌症对这类治疗的耐药性。”
免疫系统对癌症的监控被认为是通过推动癌细胞的进化来促进恶性肿瘤的发生,而癌细胞的进化可以破坏免疫系统的检测和攻击机制。“免疫编辑”理论——由路德维希癌症研究所前科学主任兼首席执行官,已故的Lloyd Old和路德维希的现任科学咨询委员会成员Robert schreiber最著名地提出——现在是肿瘤免疫学的基本原则。
研究人员很早就知道,癌细胞共同的代谢适应——比如它们对葡萄糖的大量消耗——会破坏抗肿瘤免疫反应。然而,目前尚不清楚的是,免疫监测是否也能诱导癌细胞的代谢适应,以及这些适应是否还能帮助它们抵抗免疫反应。这就是目前的研究所建立的,揭示了肿瘤进化的一个方面,这个方面一直被假设,但迄今为止仍未得到证实。
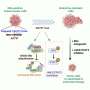
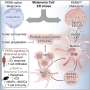
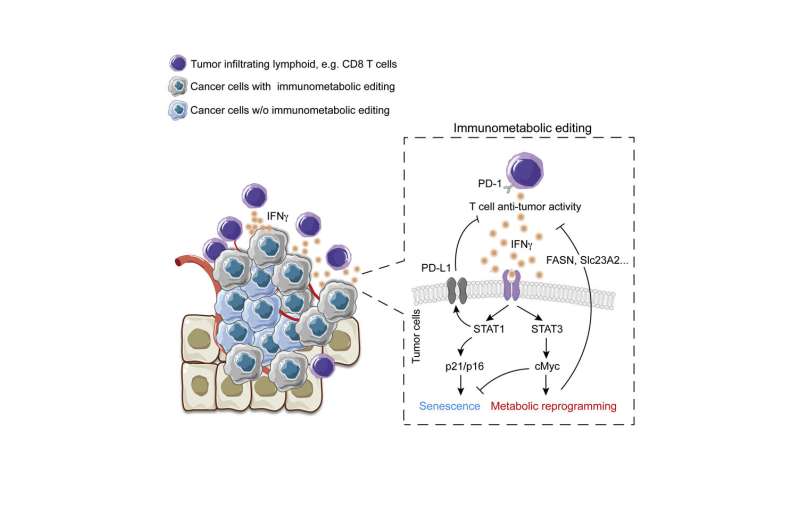
Ho和他的同事们发现了三种协调这种效应的关键蛋白质:IFNγ、STAT3和c-Myc。IFNγ是一种抗癌监测工具,由T细胞和其他免疫细胞分泌,已知可以阻止癌细胞的生长。但它触发的信号,由一种名为STAT1的蛋白质介导,也诱导癌细胞适应,帮助它们逃避T细胞的攻击,这一过程被称为免疫编辑。
研究人员在目前的研究中表明,IFNγ还激活了一个独特的、很少被探索的信号通路,由一种名为STAT3的相关蛋白质介导。这种途径通过诱导决定哪些基因活跃的“表观遗传”变化来改变癌细胞基因组的表达模式。它还会过度激活一种被称为c-Myc的细胞代谢主调节因子,这种调节因子在许多癌症中都过表达。
研究人员表明,由c-Myc激活的基因不仅影响癌症代谢,还会破坏T细胞渗入肿瘤并使其无法攻击癌细胞。事实上,由STAT1和STAT3介导的信号通路似乎协同赋予突发肿瘤避免免疫清除的关键能力,推动免疫代谢编辑,帮助它们进化成成熟的恶性肿瘤。
Ho说:“以前的研究表明,癌细胞中STAT3活性的丧失促进了免疫浸润并诱导肿瘤消退。”“我们的研究结果解释了为什么用药物靶向STAT3可以恢复癌细胞对IFNγ的敏感性,这些癌细胞已经进化到抑制范围之外。”
研究人员还使用CRISPR基因组编辑技术筛选了小鼠肿瘤中的2078种代谢酶,并确定了由c-Myc控制的40种代谢基因,这些基因在帮助癌细胞逃避免疫监视和攻击方面发挥着重要作用。这些酶也是药物靶向的主要候选者。
“除了它的药理学意义,”Ho说,“这项研究揭示了免疫编辑的一个以前不被重视的维度,这将影响我们对两者之间代谢对话的理解癌症细胞和免疫细胞在肿瘤微环境。”
更多信息:Chin-Hsien Tsai等人,免疫编辑指导肿瘤代谢重编程以支持免疫逃避,细胞代谢(2023)。DOI: 10.1016 / j.cmet.2022.12.003