研究人员发现了早期阿尔茨海默病的新生物标志物
新墨西哥大学神经学家Rawan Tarawneh医学博士发现了一种独特的生物标志物,可能会导致新的诊断测试,以改善在症状出现之前对早期阿尔茨海默病的检测。
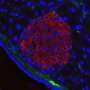
在一篇发表在临床和转化神经病学年鉴2022年11月,Tarawneh和她的同事发现了一种新的蛋白质脑脊髓液能够可靠地检测到阿尔茨海默病中内皮损伤——对大脑中微小血管内衬细胞的损伤。利用这一生物标志物,Tarawneh的团队发现,即使在疾病的早期症状前阶段,内皮损伤也是认知障碍的重要因素。
这些发现为600多万美国老年痴呆症患者带来了一线希望,其中包括43000多名65岁及以上的新墨西哥人,因为它们可能会刺激进一步的药物干预研究,以潜在地防止大脑内皮受损。
“所有这些都是新的,”新墨西哥大学神经学系副教授Tarawneh说,他是新墨西哥大学认知神经病学部门的主任,也是记忆与衰老诊所的主任。“这些都是新颖而令人兴奋的发现。”
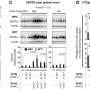
在研究700名具有阿尔茨海默病生物标志物证据的认知正常参与者时,Tarawneh与来自新墨西哥大学和华盛顿大学奈特阿尔茨海默病研究中心(ADRC)的研究人员一起,包括基因组学核心主任Carlos Cruchaga博士。研究参与者在奈特华盛顿ADRC注册,都经历了详细的临床,认知,MRI和PET扫描以及生物标志物评估,包括测量一种称为血管内皮钙粘蛋白(VEC)的内皮损伤新标志物。
研究小组发现,与对照组相比,他们的脑脊液VEC水平甚至在阿尔茨海默氏症的各个阶段都有所升高,甚至在记忆丧失开始之前。当与已建立的阿尔茨海默氏症生物标志物,如淀粉样蛋白和tau蛋白结合时,脑脊液中的VEC水平提高了这些标志物检测早期阿尔茨海默氏症病理的能力。
Tarawneh说:“我们的研究表明,内皮损伤在阿尔茨海默病的早期过程中起着重要作用,并与记忆、认知功能和突触可塑性直接相关。”
此外,研究人员发现,在这些早期临床前阶段,VEC水平与认知结果的相关性与淀粉样蛋白和tau相似,即使在调整小血管疾病的成像测量时也是如此。
“我们发现,我们可以可靠地测量阿尔茨海默病患者大脑中的内皮损伤,内皮损伤实际上与认知结果相关,与淀粉样蛋白和tau蛋白的程度相似。我们还发现了内皮细胞独立于淀粉样蛋白和tau蛋白影响记忆和学习的几种途径。”“所以,这证明了,是的,内皮-血管内膜-与死亡有直接关系认知障碍."
多年来,研究人员专注于在显微镜下观察到的脑组织变化,其中包括β -淀粉样蛋白和另一种叫做tau的蛋白质。
β -淀粉样蛋白是一种天然存在的蛋白质,在阿尔茨海默病患者体内,它以异常水平聚集在一起,形成斑块,在神经元之间聚集,破坏细胞功能。Tau是一种聚集在神经元内的蛋白质。在阿尔茨海默病中,tau蛋白从作为神经元结构支撑的微管中分离出来,并粘附在其他tau分子上,形成密集的缠结。
研究人员仍在试图确定这些变化中哪些可能导致阿尔茨海默氏症,哪些可能是这种疾病的结果。
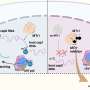
长期以来,内皮损伤被认为是继发于淀粉样蛋白和tau蛋白毒性。然而,最近的研究已经开始阐明内皮和其他血管成分在触发导致阿尔茨海默病的级联事件中的重要性。
研究表明,不仅淀粉样蛋白的毒性水平和tau蛋白的异常积聚会导致内皮损伤,而且相反的情况也是正确的:淀粉样蛋白和tau蛋白水平的增加可能是由于内皮损伤。
Tarawneh说:“现在我们看到,内皮损伤可能是诱发事件,淀粉样蛋白和tau蛋白是次要事件。”
Tarawneh假设某种形式的微循环衰竭发生在毛细血管,血管内皮细胞受损。
“一旦内皮受损,就会导致淀粉样蛋白和tau蛋白的聚集。然后淀粉样蛋白tau蛋白会导致进一步的内皮损伤,因为它们是有毒的,”她说。“这是一个恶性循环。”
在21世纪初,Tarawneh的祖母被诊断出患有阿尔茨海默病。Tarawneh对该领域缺乏研究感到沮丧,因此被迫从事神经学事业,研究阿尔茨海默病对大脑的影响。
“即使是现在,我们能提供给病人的选择也很少,”她说。“当你看到你爱的人认不出你时,这是一种可怕的经历。这是一个令人心碎的情况。”
展望未来,Tarawneh说她想做更多的研究来了解内皮细胞是如何参与阿尔茨海默病的。她说,这项工作可以促进进一步研究药物干预预防和/或愈合内皮损伤。
Tarawneh说:“也许瞄准它将是治疗这种疾病的一种方法。”“这是药物研发的新途径。”
Tarawneh计划进一步进行这项研究。她说:“我的目标是在新墨西哥大学招募越来越多的参与者,并从他们身上获得脑脊液和血液样本,这样我们就可以验证这些结果,并扩展我们之前的工作。”
更多信息:Rawan Tarawneh等人,血管内皮-钙粘蛋白作为临床前阿尔茨海默病内皮损伤的标志物,临床和转化神经病学年鉴(2022)。DOI: 10.1002 / acn3.51685