表观遗传药物有望战胜罕见癌症
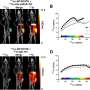
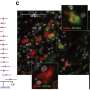
![Viability, SSTR2 protein levels, and [ 68 Ga]Ga-DOTA-TATE uptake of MPC and MTT cells treated with epigenetic drugs; (A) Sequence of investigations after treatment with VPA and DAC as single and combination doses with different concentrations; (M) measurements; (B) Dose-response-curves showing reduction of cell viability in response to increasing concentrations of epigenetic drugs; dose ranges of DAC (dashed area) and VPA (dotted area) for investigations on SSTR2 modulation: (C) Western-Blot analysis showing changes in SSTR2 protein levels of cells upon ET; relative quantity: SSTR2/ACTB ratio normalized to the average of MTT [Controls]; (D) SSTR2 radioligand assay showing changes in [ 68 Ga]Ga-DOTA-TATE uptake of cells upon ET; significance of differences: * P < 0.05, ‡ P < 0.01, # P < 0.001. Credit: Theranostics (2022). DOI: 10.7150/thno.77918 战胜罕见癌症的使命](https://scx1.b-cdn.net/csz/news/800a/2023/mission-to-beat-rare-c-1.jpg)
每十万人中只有一人患有嗜铬细胞瘤,这是一种肾上腺肿瘤。如果肿瘤已经转移,可以使用放射性化合物来检测已经扩散到身体其他部位的恶性细胞,并从内部对它们进行照射。
然而,含有β发射极Lutetium-177的制剂只有在有足够的靶分子时才能与肿瘤结合,而情况并不总是如此。通过在治疗前给予两种批准的药物,赫姆霍兹-德累斯顿-罗森多夫中心(HZDR)的一个研究小组成功地增加了小鼠模型中放射性核素治疗的靶分子数量,推迟了治疗时间肿瘤的生长.
嗜铬细胞瘤是一种罕见的肾上腺肿瘤。它们由神经内分泌细胞发育而来,神经内分泌细胞通常也会产生应激激素。大多数这类肿瘤的细胞表面都有一种独特的目标结构——生长抑素的受体。这为专家对抗病变细胞开辟了一条道路。放射性标记的分子,被称为治疗性放射性药物,与受体对接,导致细胞死于传递的辐射。周围的健康组织完好无损。
医生对罕见病不感兴趣制药行业因为它们的案件数量较少,利润预期也相应较低。HZDR放射性药物癌症研究所系主任Jens Pietzsch教授说:“我们认为,在这种情况下采取行动是公共资助的研究的责任。”
“以嗜铬细胞瘤为例,我们知道靶向放射性核素疗法可以阻止肿瘤生长。2型生长抑素受体越多肿瘤细胞产生的效果越持久。在我们的实验中,我们能够将辐射剂量被肿瘤吸收了,”生物学家说,他描述了最近发表在该杂志上的研究的一个关键发现开展.
更重要的是,德累斯顿的研究人员发现了可能导致肿瘤复发的基因。这代表着未来开发更多治疗神经内分泌肿瘤的药物向前迈出了一大步。
在恶性嗜铬细胞瘤患者中使用治疗性放射性药物镥-177- dotatate正在作为一种有前途的治疗策略进行研究。作为一种β发射器,镥-177在衰变时释放电子,导致细胞死亡。
然而,这一过程也会以伽马辐射的形式产生能量,可以使用单光子发射计算机断层扫描(简称SPECT)方法进行可视化。核医学医生根据图像数据确定肿瘤内沉积的辐射剂量。他们对肿瘤的个体特征——它的分子指纹——了解得越多,治疗成功的机会就越大。
肿瘤的个体性
因此,在治疗不能手术的嗜铬细胞瘤之前,需要进行精确的诊断,以确定是否有足够的受体进行放射性核素治疗(也称为内放射治疗)。
“生长抑素2型受体的形成因肿瘤而异。有些产生增强的水平,而另一些则完全没有。我们的目的是使用已批准的药物在内放射治疗前增加受体的数量,以便更多的患者在未来从治疗中受益。鉴于药物已经被批准,下一步临床应用是短的,”Jens Pietzsch团队的生物学家Martin Ullrich博士解释道。
研究人员选择了两种药物进行预处理:丙戊酸和地西他滨。丙戊酸主要用于治疗癫痫和癫痫发作;地西他滨用于治疗某些白血病。然而,从细胞实验中得知,这两种化合物也能刺激生长抑素受体的产生。因为他们不直接改变遗传信息但仅仅是为了更容易读取基因,它们被归类为表观遗传药物。
为了确定这两种化合物在嗜铬细胞瘤中是否具有预期的效果,首先在细胞材料上(体外)进行了试验,鉴于有希望的结果,最终也在小鼠模型上进行了试验。“它们是多臂治疗方案的独立分析。所有试验都重复了几次,有时只使用一种药物,有时两种都使用。当然,也与未经治疗的对照组进行比较。”Ullrich说道。
结果:当表观遗传药物丙戊酸和地西他滨在内放射治疗前几天服用两次,治疗性放射性药物黄体素177- dotatate的积累——因此靶向放射剂量也在肿瘤中增加了一倍。
Ullrich使用HZDR上的小动物SPECT摄像机进行了测量,他已经为小鼠模型进行了优化。根据调查结果,联合治疗使肿瘤控制的时间比仅仅使用放射性药物要长得多。然而,在联合应用于患者之前,还需要进一步的临床前研究。
肿瘤复发
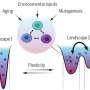
肿瘤通过打开或关闭某些基因来抵抗辐射的影响。这意味着即使在内照射治疗后,它们也经常在一段时间后开始再次生长。为了寻找未来进一步降低这种治疗耐药性的策略,HZDR研究人员将辐照肿瘤的组织样本发送给德累斯顿大学医院的苏珊·里希特博士基因分析该研究是与NCT/UCC(德累斯顿国家肿瘤疾病中心)合作开展的。
得到的是超过55000个基因的列表,被称为转录组,Ullrich能够通过广泛的数据分析和研究将其缩短到可管理的长度。他总结道:“在内放射治疗期间发生显著变化的基因包括几个可能成为放射增敏联合治疗靶点的候选基因。”
部门负责人Pietzsch说:“现在有了这些全新的数据,事情变得非常令人兴奋。”“我们正在开辟新天地。现在我们需要一点运气来捕获正确的基因。”他们的计划是在未来几年内完成对所选基因的另一轮实验。
“在表观遗传药物和治疗性放射性核素的联合治疗之后,有望很快投入临床使用,然后可能会有另一个治疗步骤:关闭耐药基因的药物肿瘤佩茨希谨慎地展望着未来,说道。研究人员还希望,届时不仅可以克服罕见的嗜铬细胞瘤的辐射抵抗,还可以克服其他神经内分泌肿瘤的辐射抵抗。
更多信息:Martin Ullrich等人,生长抑素2型受体放射性核素治疗和小鼠嗜铬细胞瘤模型辐射转录组学的表观遗传药物,开展(2022)。DOI: 10.7150 / thno.77918