脊髓性肌萎缩症中骨骼肌病变的发病机制
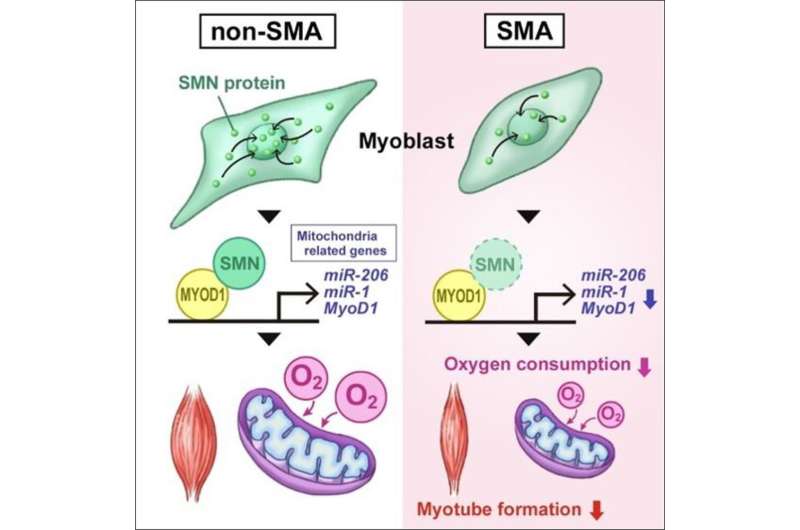
Megumu K. Saito教授和他的同事发现,SMN是一种参与脊髓性肌萎缩(SMA)的蛋白质,在骨骼肌分化过程中通过调节miRNA的表达和MYOD1来促进线粒体的功能成熟。
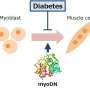
脊髓性肌萎缩症(SMA)是一种先天性神经肌肉疾病,由编码生存运动神经元(SMN)蛋白的SMN1基因功能缺失突变引起。虽然SMA传统上被认为是一种运动神经元疾病,但最近也有骨骼肌特异性病变的报道,使骨骼肌成为SMA新的潜在治疗靶点。在本研究中,研究小组利用SMA患者来源的iPS (SMA iPS)细胞建立成肌细胞,研究了SMA骨骼肌病变的发病机制。
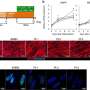
该小组还通过使用shRNA敲除来自健康个体的iPS细胞(非sma iPS细胞)中的SMN1,生成了缺乏SMN1的iPS细胞。研究小组发现,从smn1缺陷的iPS细胞分化而来的骨骼肌细胞和SMA iPS细胞都表现出线粒体耗氧量的降低。此外,骨骼肌分化过程中对线粒体功能至关重要的内源性MYOD1、miR-1和miR-206的表达水平也降低了。
接下来,研究小组研究了SMN在骨骼肌分化过程中的功能。非sma iPS细胞骨骼肌分化3天后SMN1表达增加,SMN蛋白均匀分布在细胞核内。这些观察结果表明,SMN在分化过程中与DNA相互作用以控制转录。ChIP-qPCR一致显示SMN结合在MYOD1转录起始位点上游的基因组区域。此外,免疫共沉淀分析证实SMN和MYOD1蛋白在物理上相互作用。
先前的研究表明,miR-1和miR-206的转录是通过MYOD1结合到它们的转录调节区来调控的。因此,研究人员通过ChIP-qPCR检测了SMN与miR-1和miR-206转录调控位点的结合,发现它也与这些miRNA基因结合。这些结果表明,SMN在骨骼肌分化过程中特异性参与MYOD1、miR-1和miR-206的转录调控。
最后,研究小组研究了在骨骼肌中引入miR-1和miR-206(在SMA模型中下调)是否能有效治疗SMA。结果显示,引入miR-1和miR-206后,线粒体耗氧增加,肌管细胞形成改善。在功能上,miR-1和miR-206转染使SMA模型小鼠肌管细胞的收缩速度恢复到与野生型肌管相当的水平细胞.这些结果表明miR-1和miR-206是拯救骨骼的有效靶点肌肉SMA的病理学。
本研究确定了该病的发病机制之一骨骼肌SMA病变。研究小组希望他们的工作能够在未来引领针对骨骼肌的新疗法的发展。
这项研究的结果发表在生命科学联盟2023年1月5日。
更多信息:Akihiro Ikenaka等人,SMN通过调节my奥德- mirna轴促进肌生成过程中的线粒体代谢成熟,生命科学联盟(2023)。DOI: 10.26508 / lsa.202201457