新评估临床试验可以并且应该如何进行

在他的统治期间(公元前605年-公元前562年),尼布甲尼撒二世,巴比伦王,苏美尔、阿卡德和所有的宇宙,决定节食完全由肉和酒确保身体健康,所以命令他的臣民或多或少吃什么。
不是每个人都同意了,尼布甲尼撒,也许好奇,允许不同组食用豆类的饮食和水。10天后,数据是在:legume-eaters显然是更好的比肉食者的滋养。
圣经中记载的但以理书》,尼布甲尼撒的实验是可能是第一次有记录的临床试验人类历史上,虽然今天的黄金标准的进化路径随机、双盲、安慰剂对照临床试验需要几个世纪的不断变化和改进。
COVID-19大流行,在某些方面,另一个拐点。在所有其他方面的流行改变了我们的生活方式和思考,它促使新的评估和重新设计的临床试验可以并且应该进行。
以前所未有的速度和范围,一双疫苗根据Pfizer-BioNTech信使核糖核酸(mRNA)技术和现代化加速通过测试获得紧急使用批准(欧洲大学协会)所需的时间历史的一小部分。他们已经接种超过10亿世界各地的人们以防止或减少伤害或死亡导致COVID-19 SARS-CoV-2病毒感染。
“大流行证明临床试验可以快速执行和安全危机时,当足够多的人受到影响,和美国食品和药物管理局(FDA)和其他政府组织认识到紧迫感,”斯蒂芬·斯佩克特说,医学博士儿科的特聘教授,加州大学圣地亚哥分校医学院的首席研究员,加bob电竞州大学圣地亚哥分校的现代化试验。
“不是每个研究可以与这种级别的执行效率,但已经吸取了教训,当应用于当前和未来的研究,有助于加快重要的审查和批准新的试验性疫苗和药物。”
在大流行的高度,看似活泼的COVID-19 mRNA疫苗跑欧洲大学协会担心许多,他们担心这个过程太匆忙,科学也不确定,不过联邦基金以后估计美国疫苗接种计划阻止了超过110万人死亡,1030万人住院。
“我们的估计表明,仅在2021年,疫苗接种程序阻止潜在的灾难性洪水的病人需要住院治疗。很难想象医院将如何应对有他们面对1000万人生病到需要承认,“联邦基金的作者写道。
“除了减少住院和死亡,接种疫苗预防数百万COVID感染,减少数以百万计的美国人将发展前景long-COVID及其衰弱症状。”
信使rna的无可争辩的成功故事COVID-19疫苗和如何实施的细节所以快速添加燃料持续争论的性质和过程的临床试验,尤其是如何,应该需要改变。
加州大学圣地亚哥分校卫生研究者和医生监督和管理每年数以百计的新的和正在进行的临床试验。目前有超过1000列在其网站clinicaltrials.ucsd.edu。任何机构在该地区进行更多的试验或在更广泛范围的疾病,治疗方法和条件。任何机构正努力使它们更有效。
“传统的双盲,安慰剂对照试验仍然是黄金标准,但是替代品出现,”加里·s . Firestein说医学博士,director of the Altman Clinical and Translational Research Institute at UC San Diego, which provides scientific, clinical, administrative and logistical support to clinical trials at UC San Diego.
(双盲研究中,参与者和研究者都不知道是谁接受治疗或者安慰剂。目标是最小化期望偏差,导致患者或医生观察改进即使“假”药。)
在新兴的替代能源和变化:
- 适应性试验过程中可以改变治疗方法和条件变化
- 使用来自现实世界的数据电子健康记录(EHR)
- “硅”试验基于计算机模拟结合EHR信息
- 开放标签试验的卫生服务提供者和病人都意识到前使用代理生物标记,如存在与否的specific-Trials在美国食品和药物管理局(FDA)“动物规则”人体试验是不可能的
加速药物开发
新的药物或治疗可以达到市场之前,必须经过几个阶段的测试和评估,从临床前研究开始,这可能需要花费数年的时间,有时几十年。信使rna COVID-19疫苗的原因之一可能是投入临床试验的方法已经是事实的主题为其他疾病的多年的研究和试验。
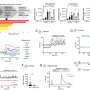
一般来说,需要7到10年的临床试验成功地通过所有四个阶段(见下图),虽然不再并不少见。已经进行了很多尝试缩短这一过程。
例如在2016年,国会通过了21世纪治疗法案,旨在简化部分药品和器械的批准。一些政府官员和其他人,那么现在,主张简单地删除试验,表明有前途的新药可以向公众发布后只满足基本的安全要求。
2017年,吉姆•奥尼尔曾在美国健康与人类服务部门宣称,“我们证明他们已经合法化后功效。”
大多数专家不去那么远。
“缩短临床试验有可能干预研究阶段太快。干预可能无法探测到的结果在一个持续几周而不是几年的试验,”安东尼Magit医学博士说手术和医学教授办公室主任IRB政府在加州大学圣地亚哥分校。
“以创新的研究设计,包括更好的描述主题,更少的对象可能需要注册,但长时间研究可能需要评估更广泛的结果。批准后长期随访的临床护理可能是一个重要组成部分评估持续为负效益和监控的结果。”
乳腺癌的临床试验药物它莫西芬,例如,开始于1970年代;后期试验正在进行。
一些专家主张修改第三阶段的临床试验,他们认为不必要费时,昂贵的和冗余的。他们支持“适应性许可”,特别是对于解决重要或紧急需求的有前途的治疗,如新疫苗、抗生素、癌症药物或治疗阿尔茨海默氏症。
这些药物将会推出更早、更快,有限的开始阶段结束后分发给重病患者早期即接受者会被监控,如果药物出现安全有效,可用性将会扩展到更多类别的患者中,这一过程被称为“进步减少不确定性。”
一个问题是,安全信号可能不是在有限的试验,Firestein说,不放心和有效性。这可以创建问题与第三方费用谁承担成本昂贵的药物,可能不工作。
Sandip Patel,医学博士,associate professor at UC San Diego School of Medicine and director of the clinical trials office at Moores Cancer Center at UC San Diego Health is among those advocating for modified trials.
“在癌症临床试验,有一个运动强调小说治疗意图在历史强调统计平衡,改善获得试验,”帕特尔说。
“与当前时代关注小说从第一阶段治疗记录的审批时间来帮助病人,如COVID-19努力,以及保持警觉在药品的生命周期试验和实际使用,我认为旧模式的第一阶段第二阶段第三阶段作为离散元素是一个过去的遗物。”
人形卓越中心的研究,网络医学研究所的平移的手臂在加州大学圣地亚哥分校医学院的成立联合主任Soumita Das,博士和Pradipta Ghosh,医学博士董事和员工的考特尼•谈论另一种方式来调整临床试验。它始于“阶段0。”
目前的多阶段是艰巨的,但不一定有成效。大多数药物失败在管道,观察Das,许多在初选的最后阶段,因为缺乏有效性。换句话说,他们永远不会有机会。
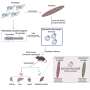
人形的方法利用人类瀑样模式”diseases-in-a-dish。”These multi-dimensional, multi-cell-type mini-organs can be a more realistic replication of complex human tissues than single cell cultures or most animal models. (See page 68 for more on organoids.) If an experimental compound doesn't work in an organoid (Phase 0), it can be jettisoned with less waste of time and resources, said Das.
“人形organoid-based模型提供优秀功效,给研究者一个令人难以置信的工具从死角分离有用的治疗方法。这是我们如何加速药物发现过程,给患者带来新的希望。”
临床试验的目的是评估一个新的药物或医疗设备是否安全有效。
解决问题(至少他们中的一些人)
问题1:多样性
医学研究的历史充满了故事的女性bob88体育平台登录和少数民族弱势或滥用,即臭名昭著的塔斯基吉梅毒研究,研究人员研究了未经处理的影响在黑人男性在过去的40年。
据估计,多达90%的临床试验参与者曾经是欧洲血统的白人和代表,虽然疾病明显影响不同的人以不同的方式。2022年的一项调查显示超过20000美国从2000年到2020年的试验与发表的结果发现,只有不到一半报道任何种族/民族数据。大多数学者(平均79.7%)白色,与所有其他种族/民族弱势人口普查相比估计。
“推动现在涉及到多个站点和不确定的关于种族、民族和社会经济多样性代表社会的多样性,“Magit说。“关键组件代表尽可能多的社会提供性别平等在临床试验招募,随着临床试验历史上过多的雄性。总体目标是进行临床试验,结果直接可翻译受影响的人口,而不必做出调整由于狭窄的入选标准或只包括受影响人口的一个子集。”
多样性是必不可少的司机COVID-19疫苗试验。疾病影响人们无处不在,但至少在美国,袭击了少数民族特别是难,较高的住院和死亡。
斯佩克特指出,以极大的努力,336名研究参与者的现代化疫苗试验在加州大学圣地亚哥分校,超过50%代表少数民族和人的颜色。
苏珊,医学博士,professor of medicine at UC San Diego School of Medicine and principal investigator for the UC San Diego study arms for two international COVID-19 vaccine trials (Astra-Zeneca and Johnson and Johnson) said the emphasis in both trials was increased participation in underserved communities, particularly those of color. These populations are traditionally underrepresented in clinical trials and remain overrepresented in rates of SARS-CoV-2 disease, hospitalization and death.
一个可见的方法,她说,是创造流动诊所,包括专门配备车辆,让疫苗接种机会社区居民不可能或无法访问一般的大学校园测试网站。诊所通常是由当地的卫生保健提供者,增加熟悉和信任的过程。
“SARS-CoV-2流行不成比例地影响了社区的颜色在美国,”说。“这些车辆帮助我们的研究团队把疫苗试验的机会高负担可能缺医少药社区。”
问题二:获取数据
在2014年,Thomas Insel医学博士,director of the National Institute of Mental Health (NIMH) from 2002 to 2015, noted that one of the reasons mental illness was so poorly understood is the lack of knowledge about the underlying brain mechanisms involved, including how they worked or malfunctioned.
NIMH Insel引入了一个新政策,要求精神疗法的临床试验包括基础研究。这样,即使试验失败了,研究人员可能至少了解大脑是如何工作的。
自从2016年在加州大学圣地亚哥分校负责人阿尔茨海默病合作研究(adc),霍华德·费尔德曼,医学博士,professor of neuroscience, has redirected efforts away from high-profile, large, late stage clinical trials in Alzheimer's disease (which so far have had an extremely high failure rate and which have not resulted in an approved, market-ready, payer-supported treatment) to smaller, more nimble studies directed at achieving clinical proof of concept as a strategy to buy down risk of later stage costly failures.
“我们努力保持专注于高质量的研究和实现研究目标,回答重要问题的方法,这将使一个差异在我们的病人的生命,”费尔德曼说。
“在加州大学圣地亚哥分校,我们适合协作的学术领导临床试验,在研究不太可能做的行业,或者在adc可能是一个理想的合作伙伴。通过贡献前期试验成功完成每一步帮助使我们更接近我们的目标在风险中获益的人或与阿尔茨海默氏症”。
问题3:共享数据
2007年,美国成为第一个国家启动数据库涉及药物的临床试验结果,设备和生物制剂,如疫苗。重要描述的法律处罚未能遵守,如扣缴联邦资金。目的是鼓励分享的信息,特别是如果试验失败,因此,未来的研究将更好的通知。
还没有完全解决设想,即使2017年更新的国家卫生研究院(NIH)和食品及药物管理局颁布了一项“最终规则”澄清期望和处罚。许多临床试验的结果仍然是未知的,特别是对于那些失败或不足。
例如,在2020年,科学调查了超过4700个试验的结果应该被派往ClinicalTrials.gov网站。报告率提高2017年统治之后,但《华尔街日报》报道,数以百计的试验没有公布的数据。
也许并不奇怪因为整个临床试验成功的可能性从第一阶段到市场批准小于10%,几乎70%的试验不跳从第二阶段向第三阶段。
”发布一个消极的结果,没有人会兴奋,很难在顶级期刊上发表他们,“Firestein说,他注意到,也试验斗争或未能获得足够数量的参与者往往会导致动力不足和怀疑的结果。
招聘是一个几乎普遍的挑战;80%的试验延迟或关闭,因为很难找到参与者。10的试验双原来的时间表以满足招生目标。一个在10试验网站不能注册一个参与者。
问题4:让药物和疫苗的孩子
COVID-19疫苗证明一种常见的医疗挑战:批准儿童救命的疫苗和药物。截至2018年,发表在《卫生事务》上的一项研究显示,64%的儿童没有批准新药,尽管具体法律和政策旨在促进它们的发展。
事实上,超过30%的处方为儿童写涉及标示外使用药物治疗疾病的药物实践或医疗条件,这不是正式批准治疗。
“这是担心孩子太脆弱参与临床试验首次在成人之前,美国食品及药物管理局的批准,”斯佩克特说。“然而,对于严重疾病,药物在儿童和成人可以并行研究一旦第一阶段数据已经证明药物的安全性和药代动力学性质进行调查。
“显著增加感染未接受免疫接种的儿童在三角洲和ο一波又一波的COVID-19证明当孩子不包括在最初的疗效试验,他们不必要把疾病风险继续。”
FDA批准了欧盟配额mRNA COVID-19 5到11岁的儿童疫苗在2021年10月,几乎一年后的第一个欧洲大学协会的成年人。孩子5至6个月的欧洲大学协会2022年6月被授予。
信使rna的消息
信使RNA在1960年代初,发现了一个链的核糖核酸互补的两股DNA的基因,它提供了蓝图制造蛋白质。然而,信使rna不改变DNA(一个毫无根据的恐惧一些早期COVID-19疫苗反对者的声音),并迅速衰减。
在十年内,科学家们尝试使用液滴的脂肪称为脂质体运输mRNA进入细胞,后者可能诱发特定蛋白表达进行靶向治疗。
需要另一个十年左右的mRNA之前将测试作为疫苗(小鼠流感)。到了2000年代,信使核糖核酸疫苗正在研究传染病从狂犬病Zika病毒,虽然技术和物流挑战证明是令人生畏的。辉瑞和现代化的疫苗,例如,必须储存在零下的温度保护脆弱的脂质滴。
全球的紧迫性COVID-19戏剧性地改变这种状况。可能是不遗余力。每一个潜在的疫苗需要探索,无论或成本的挑战。
信使核糖核酸疫苗COVID-19已经证明了他们的价值。他们比传统方法开发成本更低,速度更快,和他们的成功促使新的和扩大使用技术的兴趣疟疾、结核病、乙型肝炎和囊性纤维化,加上信使rna治疗几种类型的癌症。
“COVID-19疫苗证明,信使rna技术是安全的,有可能被用于许多其他疫苗和新的治疗方法,”斯佩克特说。”,但他们也发现了一个潜在的技术限制,如果事实证明只信使核糖核酸疫苗诱导短期免疫(而不是被风格变幻的病毒)的结果。所以尽管信使rna技术克服重大安全和监管障碍,这项技术的长期利益仍然需要评估和进一步细化。”
N = 1
临床试验通常是不确定的。成功到达市场的药物可能有问题后,因为意外的副作用。降胆固醇的他汀类药物,例如,在世界上most-researched和most-prescribed药物。估计有60%的美国人65岁以上的他汀类药物预防心脏病发作或中风。全球超过2亿人服用他汀类药物。
但第四阶段试验和其他研究发现他汀类药物可引起血糖异常,肝损伤,削弱肌肉疼痛或神经系统问题,包括记忆问题和在某些人的认知能力下降。这些副作用被认为是罕见的或未被发现在临床试验中,需要多年,许多用户充分揭示自己。
相反,Firestein指出,国际阿尔茨海默氏症的药物临床试验aducanumab (Aduhelm)产生了令人失望的结果,并在2019年被停止。随后回顾评估制药商建议Aduhelm一些病人受益。美国食品和药物管理局,令人惊讶的是,有争议的是,它基于迫切需要尽管压倒性的反对通过自己的专家顾问。医疗保险和医疗补助服务中心后裁定,病人的药物只是覆盖批准临床试验。
随机临床试验工作最好在预测治疗普通患者中,但大多数的疾病和条件以独特的方式在每个单独的影响。没有所谓的“平均病人。”
在统计中,符号“n”代表了个人或观察的样本总数。三期临床试验中的“n”Pfizer-BioNTech COVID-19疫苗,例如,相当于43661名参与者。
N = 1的概念,或测试的药物在单一个体,至少可以追溯到1986年,一个病人的描述实验的新英格兰医学杂志》上。单一的试验是成功的:研究人员发现了一个特定的哮喘治疗一个病人。试验刺激更大的兴趣,但N = 1试验仍比趋势异常。
“N = 1是吸引人的理性,尤其是对于罕见疾病,“Firestein说,“但是他们很难做的,昂贵的,结果常常为了大众的利益而不能通用。我通常认为它们是存活率存在这样一个可以执行适当的对照研究。”
在未来的临床试验
问研究员应该或可以改变提高临床试验的有效性,和他们的回答可能会是N =很多。已经完成的项目,如利用电子健康记录识别潜在的参与者,而不是依靠医生找到符合条件的患者或利用通讯工具,如社会媒体和广告。
临床试验要求的机构审查委员会批准(IRB),确保人类研究对象受到保护的权利和福利。近年来,转向中央审查委员,而不是在每个机构董事会,特别是对于多站点的研究。中央irb精简的过程创建一个单独的、伞对许多研究的批准。
但Firestein集中在一个特定的改进:提出试验是可行的吗?有病人满足进入标准吗?如果不是,它实际上可以做吗?
“我们想做的这几年来,但调查人员推回去,说它会干扰学术自由。但并不可行,因为一项研究患者不存在不会帮助任何人。”