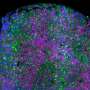
癌细胞扩散到肺部,以避免被“杀手”T细胞攻击

科学家报告称,已经扩散到肺部等部位的癌症可以对一种自然途径施加“刹车”,该自然途径应该将杀伤T细胞直接招募到它已经转移的地方。
这种新发现的策略被已经扩散的肿瘤所使用,并因此更加致命,这可能有助于解释为什么有时有希望的免疫疗法旨在帮助免疫系统杀伤癌症乔治亚医学院生物化学和分子生物学系的癌症免疫学家刘克斌博士说。
该研究的通讯作者Liu说,这也可能意味着需要额外的治疗手段来阻止一些肿瘤,这些肿瘤通常是在扩散后才被诊断出来的癌症细胞.
T细胞是癌症试图阻挡的免疫反应的驱动力,而Keytruda (pembrolizumab)和OPDIVO (nivolumab)等药物,也被称为免疫检查点抑制剂,试图释放这些“杀手”T细胞。
癌症和这些药物的共同目标是PD-1,这是一种蛋白质和天然检查点,可以使T细胞打开或关闭。
蛋白质PD-L1自然地与PD-1结合,有效地关闭T细胞,这是一件好事,有助于避免,例如,对你自己的身体组织产生过度的免疫反应,从而导致狼疮等疾病。
但是癌症篡夺了这种自然开关来保护自己,这种行为被称为“免疫逃逸”。
“PD-L1是刹车,”刘说。“PD-L1癌细胞表达是对T细胞表达的PD-1的直接反应。人们可能无法获得免疫疗法所期望的成功的原因之一是肿瘤在使用PD-L1时的聪明性。”
癌症与T细胞上的PD-1结合,有效地将它们关闭。像Keytruda这样的药物可以结合并阻断T细胞上的PD-1受体,使它们免受攻击。
但是刘和他的同事们发现,这个故事还有更多的意义,特别是当涉及到癌症的传播时,癌症的传播导致了90%以上的癌症死亡。
被称为髓细胞的免疫细胞与T细胞对话,也可以激活和阻止这些一线反应者攻击像癌症或病毒这样的入侵者。髓细胞也表达PD-1。
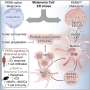
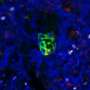
Liu和他的同事们发现,转移性肿瘤细胞也直接与这些髓系细胞上的PD-1结合,在那里它们抑制了产生1型干扰素的自然途径,他们发现,这种干扰素对于将“杀手”T细胞带到扩散的癌症家门口至关重要。
干扰素是由我们的细胞产生的一种天然蛋白质,可以帮助身体抵御病毒或癌症等入侵者。它还被合成用于治疗从皮肤癌到肝炎的各种疾病。
“肿瘤使用PD-L1与髓细胞上的PD-1结合,因此髓细胞不能产生干扰素来帮助T细胞浸润肿瘤,”Liu谈到他们在癌症转移中的发现时说。
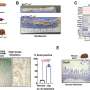
他们发现信号通路因为这种干扰素对于杀手T细胞的招募至关重要,在这种情况下,是癌细胞已经扩散到肺部的部位。他们在这种情况下发现了PD-L1癌症细胞直接与髓细胞上的PD-1相互作用抑制干扰素的产生。
他们已经在研究这种情况是否会发生在其他癌症扩散的常见部位,如肝脏。刘指出,肺和肝脏是各种癌症的常见转移部位。例如,据美国国家癌症研究所(National cancer Institute)称,乳腺癌已知会扩散到骨骼、大脑、肝脏和肺部。肝脏和肺也是肾癌、黑色素瘤以及卵巢癌、前列腺癌和胰腺癌的主要转移部位。原发性肺癌可以扩散到许多部位,包括肾上腺还有肝脏,还有肺的其他叶。
刘还在寻求一种更直接的方法来针对癌症的转移性疾病,他与波士顿大学的生物医学工程师合作,研究一种分子,可以迫使肿瘤细胞本身表达干扰素,这样它们就无法逃脱T病毒的侵袭细胞.“我们想在肿瘤的房子里放一颗炸弹,”他说。
1型干扰素是食品和药物管理局批准的第一种免疫疗法,有新证据表明,1型干扰素可以使人与人之间的对话免疫细胞他们写道,这是在肿瘤的支持性微环境中。他们和其他人已经证明,1型干扰素诱导PD-1和PD-L1髓细胞.类型1干扰素已经被证明在癌症扩散的地区是沉默的。
更多信息:John D. Klement等人,肿瘤PD-L1通过骨髓PD-1抑制I型干扰素损害细胞毒性T淋巴细胞募集,癌症细胞(2023)。DOI: 10.1016 / j.ccell.2023.02.005