FDA要求限制对乙酰氨基酚类阿片类药物中与减少严重肝损伤相关的对乙酰氨基酚

研究人员在医学杂志上报告说,美国食品和药物管理局要求限制扑热息痛和阿片类药物联合使用的药丸中对乙酰氨基酚的剂量,这与随后严重肝损伤的减少显著相关《美国医学会杂志》.这项联邦规定于2011年宣布,并于2014年实施。
“FDA要求限制对乙酰氨基酚剂量为325毫克每片联合扑热息痛-阿片类药物是否与年住院率的显著和持续下降有关急性肝衰竭涉及对乙酰氨基酚和阿片类药物的病例毒性研究负责人、阿拉巴马大学伯明翰分校外科科学家杰米·洛克(Jayme Locke)博士说。在阿拉巴马大学,洛克指导着Marnix E. Heersink医学院的综合移植研究所。
患者安全——同时仍然提供缓解疼痛-是将不同的镇痛类结合在一起的原因药物治疗.同时,多种药物应提供相加的协同镇痛,同时通过使用低剂量的每种成分来最小化毒性。
问题在于,过高剂量的对乙酰氨基酚(也被称为扑热息痛)对肝脏有毒。到2005年,一项研究发现43%的对乙酰氨基酚诱导的急性肝衰竭病例涉及对乙酰氨基酚-阿片类药物联合治疗。那么,FDA顾问小组2009年,FDA建议禁止销售对乙酰氨基酚-阿片类药物的组合药物,但FDA转而采取行动,将这些对乙酰氨基酚-阿片类药物的组合药物中对乙酰氨基酚的剂量限制在325毫克。在FDA强制要求之前,这类药物含有325至750毫克的对乙酰氨基酚。
为了检验这种变化的影响,研究人员在《美国医学会杂志》这项研究观察了两个独立的、同期的数据来源——国家住院患者样本(NIS)和急性肝衰竭研究组(ALFSG)——的年住院率和急性肝衰竭病例。NIS是一个非常大的美国住院数据库,从2007年到2019年有超过4.73亿人次住院。ALFSG是一项前瞻性的研究,研究对象为1998年至2019年在美国医学中心的32名成年急性肝衰竭患者。
在每一个数据源洛克和同事们发现,在强制执行后,与对乙酰氨基酚类阿片药物相关的住院率和急性肝衰竭病例的年发生率也有类似的下降。他们还比较了对乙酰氨基酚-阿片类药物的毒性和单独使用对乙酰氨基酚的毒性。与强制执行后对乙酰氨基酚类阿片类药物的下降相反,单独使用对乙酰氨基酚(剂量不受fda限制)的住院率和急性肝衰竭病例在联合药物强制执行后继续上升。
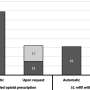
详细的结果观察了四组:NIS对乙酰氨基酚-阿片毒性、NIS对乙酰氨基酚单独毒性、ALFSG对乙酰氨基酚-阿片毒性和ALFSG对乙酰氨基酚单独毒性。对每组进行了三种不同的时间框架分析:1)2011年FDA宣布日期之前和之后,2)2014年FDA实施日期之前和之后,3)2011年宣布日期之前和2013年实施日期之后的病例冲洗比较。
作为详细调查结果的一个例子,在NIS组中,在FDA宣布前一天与对乙酰氨基酚-阿片类药物毒性相关的住院治疗的预测发生率为每10万例住院治疗中12.2例。到2019年第四季度,每10万次住院治疗中有4.4例。在宣布前,因对乙酰氨基酚-阿片类药物中毒住院的几率每年增加11%,而在宣布后每年减少11%。
在ALFSG组中,FDA公告前一天因对乙酰氨基酚-阿片类药物中毒导致的急性肝衰竭病例的预测百分比为27.4%。到2019年第三季度,这一比例为5.3%。涉及对乙酰氨基酚-阿片类药物毒性的急性肝衰竭病例的百分比在宣布前每年增加7%,在宣布后一年下降16%。
NIS数据库包括39,606例涉及对乙酰氨基酚-阿片类药物中毒的住院病例,ALFSG数据库有2,631例急性住院患者肝失败,包括465例对乙酰氨基酚-阿片类药物中毒。
作者警告说,这项研究显示的是关联,而不是因果关系。住院治疗的变化也可能来自于公众意识的提高,以及FDA作为强制要求的一部分要求更严格的标签警告,或者临床医生处方模式的变化。然而,在加拿大,在没有对乙酰氨基酚剂量限制的情况下改变标签与住院率下降无关。
更多信息:FDA要求限制处方组合阿片类产品中的对乙酰氨基酚(扑热息痛)以及随后的住院和急性肝衰竭的协会《美国医学会杂志》(2023)。DOI: 10.1001 / jama.2023.1080