2023年3月1日报告
多点多组分析揭示了终末期卵巢癌的多种耐药机制
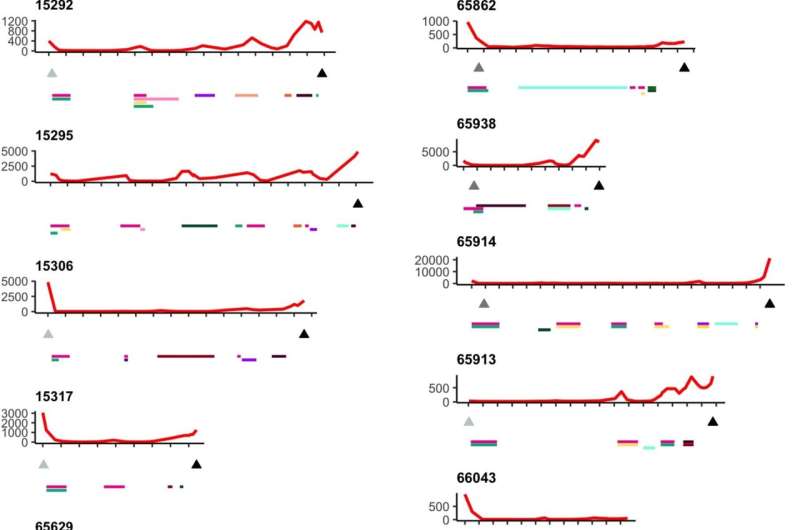
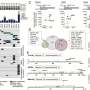
由澳大利亚墨尔本MacCallum癌症中心的研究人员领导的一个国际团队,检查了来自15名终末期高级别浆液性卵巢癌(HGSC)患者的大约270个多部位尸检样本中的391个肿瘤组织。所有提供的尸检样本都来自最初对癌症治疗有反应的患者,但在复发时对它们产生了抗药性。
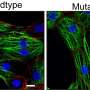
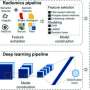
所使用的分析全基因组测序对采集样本进行不同程度的靶向基因测序、RNA-seq、蛋白质组学、甲基化和多色免疫荧光。研究人员寻找转移位点内和转移位点之间的变异,重点关注个体患者体内发生的耐药机制的数量,并发现从不同克隆细胞和亚克隆突变的数量到耐药机制的分布,存在高度的变异。
所有患者都被发现患有多克隆性疾病,平均有5个克隆,从2到9个不等。虽然癌症可能始于单克隆,即一个坏细胞复制自己的克隆,但拥有多个(多)克隆可能意味着不同细胞的多个癌症起点。不同的起点可能会使评估有效的治疗途径更加困难,因为分化的克隆可能会产生不同的治疗耐药性。相比之下,单个克隆的存在将意味着进化出一种高效、单一的抗性机制,这种机制可能能够被识别和克服。
对患者体内不同空间位点的耐药相关基因进行靶向测序,发现很少有共享突变,研究人员检测到的耐药机制很少出现在个体内的所有样本中。他们观察到趋同抗性的例子和典型的亚克隆抗性机制。广泛的基因组变异性在克隆和拷贝数畸变中是明显的,它们删除或放大大的连续代码段。
所有样本均携带体细胞致病性TP53基因突变。TP53是负责制造p53蛋白的基因,因其调节细胞分裂的能力而被称为“基因组的守护者”。在健康的情况下(非致病性突变),p53可以防止细胞过快或混乱地增殖。这个监护人在决定受损DNA是否应该修复或含有受损DNA的细胞是否应该发生凋亡和自毁方面也起着关键作用。
如果DNA被认为是可修复的,p53就会激活其他基因来修复损伤,基因比如BRCA1、BRC2和BRIP1。本研究中采样的所有患者也都有BRCA1、BRC2和BRIP1突变,使他们特别容易出现细胞修复错误,从而导致癌症,并容易受到疾病的多个初始起点的影响。
该研究表明,多亚克隆具有多样性的机制耐药性免疫系统的逃避,无论是不同的还是收敛的,都可以在终末期疾病中看到,而不是单一的耐药克隆。研究人员指出,多位点采样增加了检测新型耐药事件的能力,特别是当治疗的选择性压力加剧了从单个位点进行不平衡评估的可能性时。
研究人员总结道:“HGSC治疗干预的挑战不能被夸大,并重申了在获得这种多样性之前开发有效治疗的强大动力。”
这项研究发表在该杂志上自然遗传学.
更多信息:Nikki L. Burdett等,同源重组缺陷终末期高级别浆液性卵巢癌的多组学分析,自然遗传学(2023)。DOI: 10.1038 / s41588 - 023 - 01320 - 2
©2023科学BOB体育赌博X网络