团队确定了SARS-CoV-2的细胞进入机制和COVID-19的治疗靶点
由香港浸会大学科学家领导的一项研究发现,一种名为MT1-MMP的蛋白酶是SARS-CoV-2病毒在人体内传染性的主要宿主因子,这种病毒会导致COVID-19感染和多器官衰竭。通过应用一种名为3A2的人源抗体,可以抑制MT1-MMP的活性,感染小鼠的病毒载量减少了近90%。研究小组还证实,该蛋白酶是新冠病毒的潜在治疗靶点。
研究结果发表在自然通讯。
ACE2作为SARS-CoV-2细胞进入的受体
疫苗接种可以保护人们免受COVID-19及其潜在并发症的侵害,但对于免疫系统较弱的个体或某些令人担忧的COVID-19变体,疫苗接种并不总是有效。因此,在后疫苗时代,开发更有效的COVID-19治疗方法仍然是一项巨大挑战。了解SARS-CoV-2的细胞进入机制对于遏制病毒的传播至关重要,也将有助于寻找新的COVID-19治疗方法。
SARS-CoV-2需要血管紧张素转换酶2 (ACE2),这是一种存在于人细胞膜上的蛋白质细胞,作为进入细胞的受体。尽管肺部是受SARS-CoV-2感染的主要器官,但只有一小部分肺细胞表达ACE2。
先前的研究发现,通过ACE2的可溶性形式,SARS-CoV-2可以感染ACE2表达水平低的器官。可溶性ACE2与SARS-CoV-2结合,将病毒携带到ACE2表达水平低的细胞,并促进其进入细胞。
MT1-MMP介导SARS-CoV-2的细胞进入
浸会大学中医药学院教研部助理教授黄海良博士与香港大学微生物学系助理教授袁硕峰博士合作,进一步研究可溶性ACE2脱落的生理调节对COVID-19病因的影响。
研究小组发现,SARS-CoV-2感染会导致MT1-MMP的激活增加,MT1-MMP是一种对许多生理过程至关重要的蛋白酶。MT1-MMP介导可溶性ACE2从表达ACE2的细胞中释放。这种可溶性ACE2反过来与SARS-CoV-2的刺突蛋白结合,并将其携带到ACE2表达水平低的未感染细胞。
值得注意的是,该团队证明,引入人可溶性ACE2使SARS-CoV-2能够感染实验室小鼠品系(C57BL/6小鼠)的肺部,由于其小鼠ACE2与病毒刺突蛋白不相容,该品系自然对SARS-CoV-2感染不敏感。这一发现揭示了病毒劫持宿主酶以增强其传染性、引发多器官感染的机制。
抗体3A2阻断MT1-MMP活性
为了研究MT1-MMP的功能以及它如何影响病毒感染,研究人员使用人类细胞来制造类器官,这是一种在体外培养的3D组织结构,可以在实验室中模仿和模拟不同的器官。
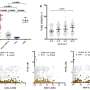
他们发现,用单克隆抗体3A2阻断MT1-MMP活性有效地降低了可溶性ACE2水平,并将SARS-CoV-2在人肺、心脏和肝脏类器官中的感染程度降低了60%-80%。使用SARS-CoV-2的原始菌株以及关注的变体(如delta和omicron)获得了一致的结果。结果表明,MT1-MMP是介导SARS-CoV-2进入细胞的主要宿主因子,也是COVID-19药物的潜在治疗靶点。
研究人员进一步测试了在小鼠COVID-19模型中应用3A2的效果。一组11只小鼠分别接受3A2或对照治疗。实验中使用年龄较大的小鼠,因为年龄是导致COVID-19严重症状和死亡的主要危险因素。结果表明,3A2降低了SARS-CoV-2病毒载量近90%,并显著减轻了感染引起的肺组织损伤。
MT1-MMP作为治疗靶点
黄博士说:“开发COVID-19药物时面临的两个主要挑战是如何提高免疫系统较弱患者的治疗效果,以及如何在不同的病毒株中保持药物的有效性。3A2不是增强患者免疫力,也不是直接作用于病毒,而是拮抗MT1-MMP的活性,因此很有可能成为治疗COVID-19的有效药物。
“我们之前的研究表明,3A2还可以预防肥胖和糖尿病,这是导致COVID-19严重症状和死亡的两个主要风险因素。因此,3A2可能特别适合高危人群,包括老年人和代谢紊乱患者。它也可能在未来对新出现的冠状病毒有效,因为ACE2是许多具有类似细胞进入机制的此类病毒的门户。在将其应用于人类之前,还需要对3A2进行进一步的研究和实验。”
更多信息:郭宣明等,mt1 - mmp介导的ACE2脱落控制SARS-CoV-2感染,自然通讯(2022)。DOI: 10.1038 / s41467 - 022 - 35590 - x