研究为多囊肾疾病的基因治疗提供了途径
常染色体显性多囊肾病(ADPKD)是最常见的潜在致命遗传疾病,仅在美国就有约50万人患有这种疾病。目前还没有治愈的方法,但新的研究可能会为治疗大多数这种疾病的新基因疗法打开大门。
几十年来,研究人员已经知道PKD1基因的突变,PKD1基因编码多囊素-1 (PC1),蛋白质在大约80%的病例中,这种病毒会导致这种疾病。然而,这种蛋白质太大了,无法进行修饰基因治疗策略。
现在,由耶鲁大学细胞与分子生理学系博士后研究员Laura Onuchic博士和细胞生物学教授、细胞与分子生理学主席兼C.N.H. Long教授Michael Caplan博士领导的研究小组发现,这种蛋白质的一小部分可能是预防疾病的关键。这一发现可能为开发一种新的治疗方法提供机会。研究小组于3月30日发表了研究结果自然通讯.
“我们的研究表明,PC1蛋白的一个微小片段——仅仅来自该蛋白尾部的200个氨基酸——就足以在小鼠模型中抑制疾病,”该研究的首席研究员卡普兰说。“我们的工作将为癌症的潜在疾病机制提供新的见解多囊肾病并揭示了开发治疗方法的新途径。”
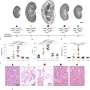
ADPKD是遗传性疾病每1000人中就有一人受影响。受影响的肾脏会形成囊肿,囊肿的数量和大小都会增加。我们每个肾脏都有大约一百万个肾元。在这种疾病中,经过几十年的发展,其中一些肾元会发育成巨大的充满液体的囊肿,挤占正常组织。随着时间的推移,这会压迫和降解肾脏的功能部分,导致肾功能丧失。
该研究的第一作者奥努奇克说:“到那时,病人的肾脏已经非常大了——可以有一个足球那么大。”相比之下,正常的肾脏只有拳头大小。
大约一半的患者会经历肾衰竭,需要透析或肾移植。此外,它可以从父母传给后代——如果父母一方是携带者,他们一半的孩子可能会受到影响。她说:“所以,这些大家庭中有很多人都患有这种疾病。”
一年多以前,由医学博士、C.N.H. Long医学教授(肾脏学)和遗传学教授Stefan Somlo领导的团队发现,如果他们在小鼠模型中去除PC1蛋白,肾脏就会变大。蛋白质重新表达后,肾脏恢复正常。
卡普兰说:“他们做了一个非常漂亮的实验,显示在多囊肾病的小鼠模型中,这些动物的肾脏中有巨大的囊肿,即使这些囊肿已经形成,恢复正常蛋白质的表达也会使囊肿消失。”
“问题是治疗策略是4300的蛋白质吗氨基酸奥努奇克补充道。“对于基因传递来说,它太大了。”Onuchic和Caplan说,解决方案可能是将ADPKD的基因治疗降低到可管理的规模。
研究人员利用基因疗法试图获取编码他们感兴趣基因的序列,并让它在他们想要的细胞中表达。这通常涉及到病毒载体。卡普兰说:“病毒可以成为特洛伊木马,将你感兴趣的基因传递到你需要的细胞中,但这些病毒的主干中只有一定的空间。”
由于PC1蛋白是大量的,这对治疗多囊肾病提出了一个问题。“PC1太大了,无法装进大众甲壳虫(大众甲壳虫是大多数基因治疗载体),但现在只有这个200个氨基酸的片段可以装进汽车的储物箱。”
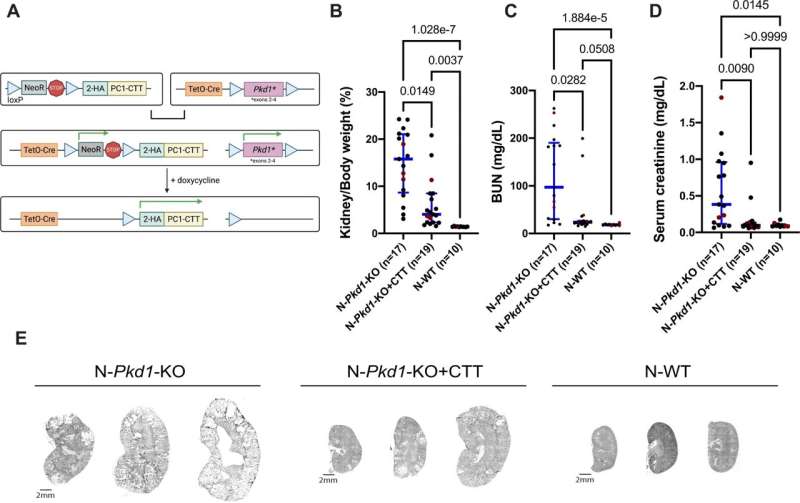
在他们的新研究中,研究小组使用了一种小鼠模型它们经过基因改造,可以关闭基因与多囊肾病有关。换句话说,他们通过在小鼠基因组中产生突变,在这些模型中诱导了这种疾病。结果,这些模型产生了囊肿。
然后,研究小组启动了该蛋白质200个氨基酸长的片段的表达。卡普兰说:“想象一下,按下一个电灯开关,一盏灯熄灭,另一盏灯亮。”“我们关闭了正常的多囊肾病基因,只打开了这一小段蛋白质的表达。”
研究小组发现,这极大地减小了囊肿的大小。他说:“尽管我们去掉了通常会导致严重囊性疾病的全长PC1蛋白,但只要打开这一小块就足以抑制疾病。”
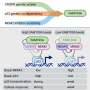
此外,研究小组还揭示了为什么这个小部件本身就足够了的机制。通过免疫沉淀,他们用一种抗体分离出这种蛋白质,然后用质谱法确定哪些蛋白质与它相互作用。他们发现一种叫做烟酰胺核苷酸转氢酶(NNT)的线粒体蛋白与PC1片段相互作用。
“从基础生物学的角度来看,这告诉我们一些关于多囊肾病蛋白的全新知识,并为研究其正常功能开辟了一条完整的途径,”卡普兰说。
该团队计划继续使用基因疗法,最初是在小鼠模型上,只有200个氨基酸片段,希望他们的工作有一天能造福人类。奥努奇克说:“从治疗的角度来看,我们有希望至少能够减缓疾病的进展,这真的很令人兴奋。”
更多信息:Laura Onuchic等人,多囊素-1的c端尾部以线粒体酶依赖的方式抑制囊性疾病,自然通讯(2023)。DOI: 10.1038 / s41467 - 023 - 37449 - 1