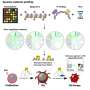
血管周围空间的生物信息学探索发现了24个基因组风险位点
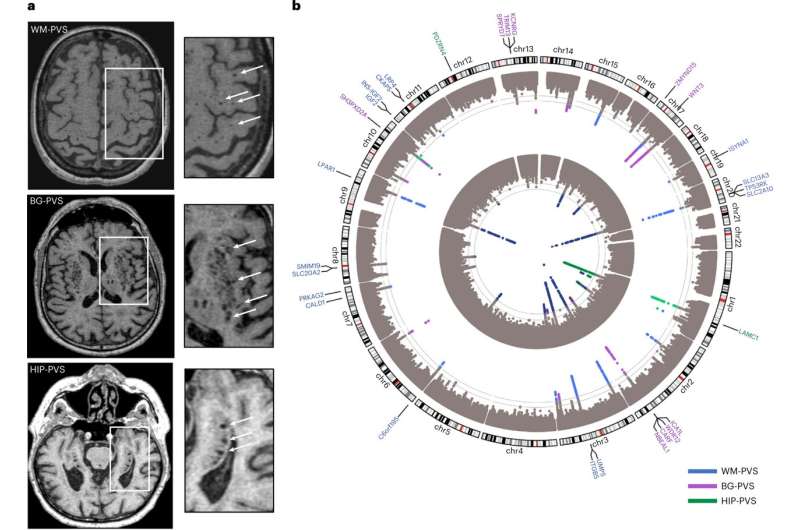
一个由79名研究人员组成的国际团队合作发表了一项研究自然医学深入研究血管周围间隙(PVS),这是一种鲜为人知的伪影,可以在脑小血管疾病的磁共振成像中看到,是中风和痴呆的主要原因。
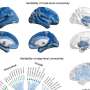
在这项研究中,“血管周围空间负担的基因组学揭示了脑血管疾病的早期机制。全基因组关联研究在18个人群为基础的队列(66.3±8.6岁,96.9%的欧洲血统)中,40,095名参与者的脑成像数据。分析发现24个全基因组显著的PVS危险位点,主要集中在白质.
这些基因座已经与年轻人的白质PVS相关(N = 1,748;22.1±2.3年),富集早发性脑白质营养不良(白质异常生长)基因和表达于胎儿的大脑内皮细胞这表明了早期生命机制。在同一期刊上发表了一篇研究简报,讨论了这些发现。
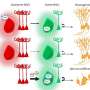
PVS是围绕小血管壁的生理空间,从蛛网膜下腔穿过脑实质。在实验模型PVS似乎是底物递送、冲洗间质液、清除代谢废物(如β -淀粉样肽)的重要管道,并作为“淋巴系统”的一部分参与脑液调节。
越来越多的证据表明,PVS在脑损伤、中风和痴呆中起着重要作用。脑内PVS扩张磁共振成像被认为是功能障碍的标志,推测反映脑液和废物清除的损害。PVS的发病率随着年龄的增长而增加血管危险因素比如高血压,它们与许多白质和血管相关的脑部疾病有关。
几项研究还表明,脑MRI上可见PVS的数量与中风、阿尔茨海默病和脑淀粉样血管病有关。卒中后水肿与卒中后PVS增大有关。
研究人员进行了一项全基因组关联研究(GWAS)荟萃分析40,095名参与者,另外19,010人进行了全外显子组/全基因组测序(WES/WGS)。他们分别对白质(WM)- pv,基底神经节(BG)- pv和海马(HIP)- pv进行了分析。
在收集了大量数据后,生物信息学探索深入到组织和细胞特异性基因表达数据库和确定的PVS风险位点的药物靶点文库中。
该研究确定了24个独立的全基因组重大PVS负担风险位点。三分之二的PVS风险位点指向不受既定风险因素介导的途径,并涉及细胞外基质血脑屏障膜运输和血管发育。
有重要的证据表明高血压和PVS之间以及PVS和BG卒中之间存在因果关系。早发性脑白质营养不良和胎儿脑血管内皮细胞中表达的基因中PVS基因座的显著富集表明,PVS基因座参与了发育过程,并参与了先前研究的血管和认知障碍药物靶点。
研究人员得出结论,这项研究发现“……提供对成人生命周期中PVS生物学及其对脑血管疾病病理生理学的贡献的见解,具有为脑血管疾病预防试验提供遗传信息的药物靶点优先级的潜力,脑血管疾病是全球中风和痴呆的主要原因。”
更多信息:Marie-Gabrielle Duperron等人,血管周围空间负担的基因组学揭示了脑血管疾病的早期机制,自然医学(2023)。DOI: 10.1038 / s41591 - 023 - 02268 - w
跨生命周期和跨祖先的血管周围空间负担基因组学;自然医学(2023)。DOI: 10.1038 / s41591 - 023 - 02269 - 9
©2023 SBOB体育赌博cience X Network