FDA批准第一个药丸粪便移植疗法
美国食品和药物管理局周三批准了第一个药丸形式的粪便microbiota-similar所谓的粪便移植疗法治疗细菌感染Clostridioides固执的,最常见的和致命的感染在卫生保健机构中找到。
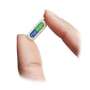
Vowst,药物被批准,以防止复发梭状芽孢杆菌人已经有了标准抗菌治疗复发性感染。它包含了生活的肠道细菌粪便样本健康的人捐赠的。
“今天的提供病人和批准医疗服务提供者一种新的方式来防止复发梭状芽孢杆菌感染,”彼得是博士,FDA生物制品评价和研究中心新闻发布会上宣布批准。“粪便微生物群产品的可用性,可以口服是前进的重要一步病人护理和可访问性的人经历过这种疾病,可能危及生命。”
梭状芽孢杆菌与15000年和30000年之间死亡每年在美国,该机构说。
感染的风险是高在65以上的人或那些削弱免疫系统,那些或疗养院住院和那些有历史的梭状芽孢杆菌感染。
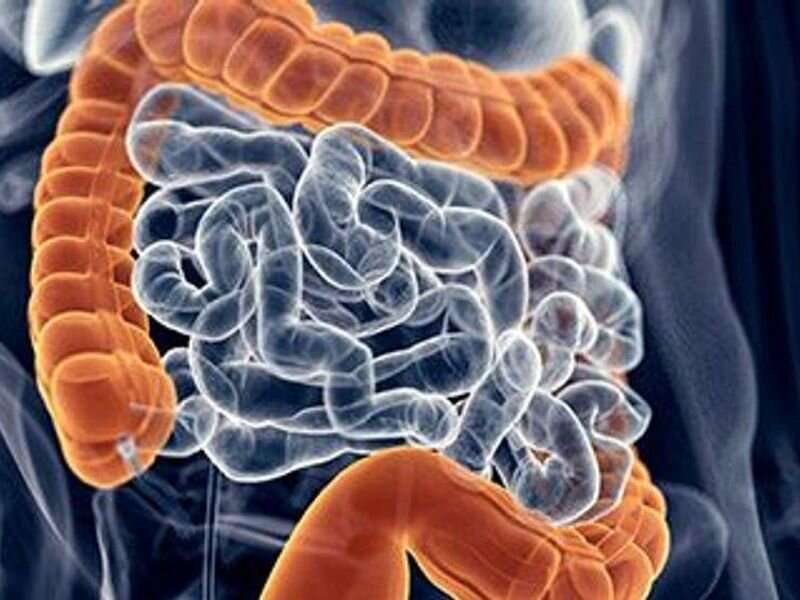
服用抗生素对感染也可以改变肠道微生物的平衡,允许梭状芽孢杆菌占据,所以Vowst可以绕过这个问题。
梭状芽孢杆菌感染导致腹泻、腹痛、发热,有时器官衰竭和死亡。每次有人感染,再感染的风险增加。
但治疗胎儿微生物群可以帮助恢复一个人的正常的肠道细菌。
在现在,这种治疗方法实施直肠给药。去年,FDA批准另一个药物级产品梭状芽孢杆菌,但它是直肠给药。
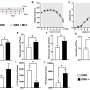
随机研究的89名参与者收到Vowst和93年获得了安慰剂,感染的复发与避孕药低8周后,12.4%的药物治疗组和安慰剂组为39.8%。
90名患者接受Vowst的另一个分析,到92年接受安慰剂相比,发现副作用包括腹胀、疲倦、便秘、发冷和腹泻。
符合条件的患者18岁,每天花四个胶囊Vowst连续三天。
药物制造商赛里斯疗法公司没有透露其定价计划,美联社报道。该公司表示,计划市场治疗与雀巢食品公司合作。
“复发性梭状芽孢杆菌感染明显影响患者的生活质量,无论是生理上还是心理上,留下许多生活在巨大的恐惧未来的复发。病人一直在等待新的治疗方案,解决一个关键问题:防止额外的CDI [梭状芽孢杆菌感染)复发,”基督徒约翰•Lillis基督教执行董事佩吉·c . diff Lillis基础教育和宣传,在公司说新闻发布会上宣布批准。
虽然捐赠者和他们的粪便被诊断为病原体的粪便处理药物之前,有可能有人通过口服避孕药可以得到一种疾病,FDA说。Vowst也可能包含食物过敏原。
更多信息:美国疾病控制和预防中心有更多梭状芽孢杆菌
版权©2023每日健康。保留所有权利。