研究人员发现成人COVID器官损伤的关键途径
即使三年以来COVID-19的出现,如何仍然不太清楚它会导致严重的疾病,包括广泛的器官损伤不仅仅是肺部。越来越多的科学家正在学习,器官功能障碍的结果损害血管,但为什么这个病毒导致损失尚不清楚。现在一个多学科小组的艾莫利大学的研究人员发现了他们认为是分子通路的关键。
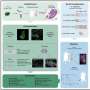
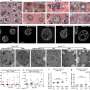
他们的研究结果发表在今天自然通讯显示,COVID-19损害最小的细胞血管,扼杀血液流动。这些结果可能为新疗法铺平道路拯救生命时数百人仍死于COVID-19每一天。
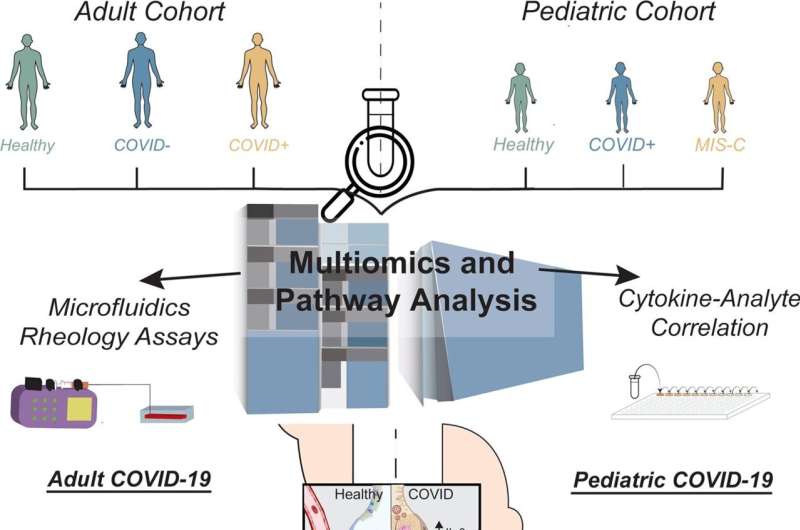
埃默里大学医疗保健医生开始这项研究在早期的大流行,为了更好地理解司机严重COVID-19,为什么成年人比孩子更严重疾病的发展。他们使用了所谓的“multi-omics”方法,研究多个数据集,检查血液的生物化学COVID病人和它non-COVID病人相比,寻找线索。
“我们惊讶我们的成人和重叠儿科患者谢丽尔·迈尔说,医学博士,博士,病理学系的助理教授和实验室医学、埃默里大学医学院和该研究的资深作者。“两组凝血异常相关,但站在成人的一个独特的途径是血管健康和血液流动有关。”
Maier说这一发现是特别有趣的临床观察,血液从患者重症COVID-19异常粘性:认为枫糖浆而不是水。
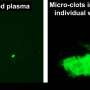
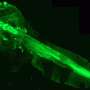
迈尔与合作者和文章的第二作者威尔伯林,埃默里大学儿科学系的教授和华莱士·h·库尔特生物医学工程学系乔治亚理工学院和埃默里大学,创建先进模型的最小的血管,将最敏感的血流量的改变,这允许他们想象bob电竞COVID-19患者与其他患者的血液如何在人体内流动。
“从这些微流控设备观看视频就像看到COVID-19实时可能影响我们的血管,”梅尔说。“这些实验室血管内衬真实人体血管细胞,称为内皮细胞。你可以把在血浆和红细胞,血和关键部件的不同组合,观察它的行为,看看发生的损害。”
纤维蛋白原:一个关键的罪魁祸首?
大流行的早期以来,医生已经看到血液蛋白纤维蛋白原非常严重COVID-19患者升高。这种蛋白质通常升高其他急性疾病,但是海拔在病情最严重的时候COVID-19高得多。身体形式血凝块部分通过降低纤维蛋白原形成纤维蛋白,血栓的关键组成部分,但纤维蛋白原本身并不认为形成凝块,抗凝血药物水平不受影响。
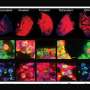
但是艾莫利大学的研究人员发现,在COVID-19病人,极高的纤维蛋白原水平的原因红细胞纠结在一起,改变血液流动和直接破坏血管内皮glycocalyx,凝胶状的微血管的保护层。“纤维蛋白原是等离子体的三大最丰富的蛋白质,”梅尔说。“这是藏在眼皮底下。”
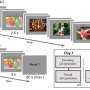
当研究人员结合患者血浆从COVID-19血红细胞在实验室血管,他们可以想象细胞聚合和量化glycocalyx内皮细胞的破坏。“你有这些大型集群的红细胞都粘在一起,”梅尔说。“这通常不会发生。毛细血管是如此狭窄,血红细胞必须通过单一的文件。但在COVID,这些聚合物粘在一起即使在流。很容易想象这机械破坏微脉管系统。”
大部分的新技术是由研究co-first作者伊丽莎白Iffrig,医学博士,博士护理研究员艾莫利大学的医学系的至关重要。“我们所做的基础是观察红细胞如何形成这些黏性物质微血管系统的大珠,“Iffrig说。
“我们的方法让我们看看这在一个动态的过程,看到所发生的这些聚集我们模拟一个真正的生理状态的血流量,而不只是暂停流体和测量他们是多大。方法允许我们同时量化这些东西。”
综上所述,这些数据表明,麦尔fibrinogen-induced红细胞聚集和导致微血管损伤的主要途径可以COVID引起器官损伤甚至死亡。
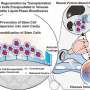
目前没有药物针对高血液中纤维蛋白原。然而团队做了探索性研究使用血浆置换治疗:去除血浆高纤维蛋白原COVID-19患者正常和取而代之的供体血浆纤维蛋白原水平。迈尔认为她的团队的发现是至关重要的,因为它提供了一个目标,可以帮助拯救生命。
更多信息:塞缪尔·Druzak等多平台系统性发病机理的分析揭示不同的司机在成人与儿童严重急性COVID-19,自然通讯(2023)。DOI: 10.1038 / s41467 - 023 - 37269 - 3