研究人员发现了与阿尔茨海默病相关的风险基因之间缺失的联系
阿尔茨海默病(AD)可分为罕见的早发性家族性AD (fAD)和常见的晚发性散发性AD (sAD),它们损害了全世界老年人的记忆和认知功能。
虽然淀粉样斑块的形成是fAD和sAD的共同脑病理,但fAD和sAD的遗传是不同的,因此可能涉及不同的发病机制;因此,应考虑不同的治疗策略。在这方面,一个价值数十亿美元的问题是,针对淀粉样斑块是否是治疗常见sAD的正确策略。
发表在神经元来自中国科学院上海有机化学研究所生物与化学跨学科研究中心的陈叶林教授团队为这个问题提供了答案。
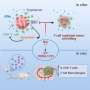
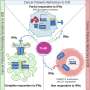
研究人员揭示了sAD最常见的致病风险因子ApoE4与fAD的致病遗传因子之间的机制关系,fAD直接促进了sAD的形成淀粉样蛋白在常见的sAD和罕见的fAD之间提供了缺失的联系。
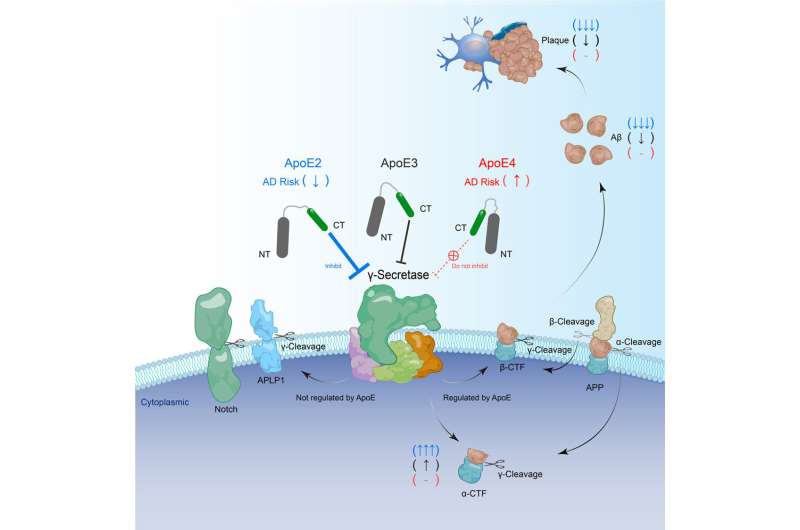
基因中编码加工酶的特定突变淀粉样前体蛋白(APP),包括APP本身和γ-分泌酶裂解亚基(PS1和PS2),通过加速fAD的形成,直接促进fAD的发展淀粉样斑块。
然而,约99%的常见晚发性sAD不携带APP或PS1/2突变。相比之下,携带两个ApoE4基因拷贝的人患晚发性sAD的风险是携带正常ApoE3基因的人的10倍。另一种变体ApoE2可以显著降低sAD的风险。
由于ApoE2、ApoE3和ApoE4的氨基酸序列仅相差1-2个氨基酸残基,不同ApoE变体对sAD发展的显著影响也一直是该领域长期存在的难题。
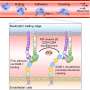
研究人员发现,不同的ApoE异构体对APP的γ-裂解有直接和不同的抑制作用,他们证明了ApoE异构体如何改变发生sAD的风险。ApoE2对APP γ-裂解的抑制作用最强,而ApoE4则没有这种抑制作用。
这一发现填补了fAD和sAD风险基因之间缺失的一环,提示APP γ-裂解异常是fAD和sAD的共同致病原因。该研究表明,ApoE的c端区域是一种具有治疗潜力的底物特异性γ-分泌酶抑制剂。
更多信息:ApoE2、ApoE3和ApoE4 c端区对γ-分泌酶的差异抑制和底物特异性抑制,神经元(2023)。DOI: 10.1016 / j.neuron.2023.03.024