第一个药丸粪便移植获得FDA批准

美国卫生官员周三批准了第一个药丸由健康的细菌中发现的人类排泄物对抗危险的肠道infections-an更简单的方法执行所谓的粪便移植。
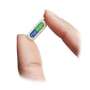
赛里斯的新治疗疗法提供了一个简单的,严格的测试版本stool-based程序,一些医学专家已经使用了超过十年来帮助病人。
美国食品和药物管理局为18岁以上成人扫清了胶囊面临风险重复梭状芽胞杆菌感染,细菌可以引起严重的恶心、痉挛和腹泻。
c . diff是特别危险的重新出现,每年导致15000至30000人死亡。它可以用抗生素杀死但他们也破坏肠道内有益细菌生活,离开它未来更容易受到感染。新胶囊批准病人已经收到抗生素治疗。
10多年前,一些医生开始报告成功粪便transplants-using凳子从健康的捐赠者恢复肠道的健康平衡,防止再感染。
FDA批准了第一个治疗的药物级版本去年从竞争对手,显示出药品。但这公司的产品,如大部分的原始程序必须被交付通过直肠。
位于马塞诸塞州剑桥的赛里斯将市场其药物作为一种侵入性较小的选项。品牌名称下的治疗将Vowst之际,养生的四个胶囊每日连续三天。
两个最近的食品及药物管理局批准的产品年的医药行业研究微生物,细菌、病毒和真菌的社区生活在肠道。
目前大部分粪便移植提供了一个凳子网络银行出现在全国医疗机构和医院。
虽然新的fda批准的选项的可用性需求预计将减少从凳子上银行捐款,一些计划保持开放。
最大的凳子OpenBiome银行在美国表示,它将继续为病人没有资格获得fda批准的产品,如儿童和成人难治性病例。它提供了超过65000人粪便样本自2013年以来对c . diff病人。

“OpenBiome致力于维护安全访问这些病人的粪便移植作为一个至关重要的最后一道防线,“Majdi奥斯曼博士说,该集团的医疗。
OpenBiome标准粪便处理成本不到1700美元,通常在几天内冻结方案的排序。赛里斯没有透露价格将收费胶囊周三晚间的一份声明中。
“我们想让医生和病人的商业体验尽可能简单,”Eric Shaff说,该公司的首席执行官,在一次采访中宣布。“方便管理我们的观点是一个方面的价值我们交付。”
赛里斯将与瑞士食品业巨头雀巢co-market治疗,这也将平分利润。赛里斯将获得1.25亿美元的里程碑付款从雀巢与FDA批准。
监督美国凳子的新兴产业银行创造了FDA监管头痛,不传统警察自制的产品和程序应用于医生的办公室。在早期的趋势,FDA警告消费者对粪便移植的潜在感染的风险,像一些人寻找可疑的“自己动手”的方法从视频和网站。
赛里斯公司高管说,他们生产过程依赖于相同的技术和设备用来净化血液制品和其他生物疗法。
该公司从凳子上开始由一小群捐助者提供各种健康风险筛查和条件。他们的粪便是同样检测许多潜在的病毒,感染和寄生虫。
然后公司处理样品消除浪费,隔离健康的细菌并杀死任何挥之不去的生物。成千上万的胶囊可以从每个粪便样本,使它更有效的过程比现有粪便移植,据该公司。
FDA警告在其宣布批准药物“可能携带传播传染性病原体的风险。Vowst也可能含有食物过敏原,”该机构说。
FDA批准治疗基于180名病人的研究中,近88%的病人服用胶囊没有经验再感染8周后,相比之下,60%的人接受了安慰剂。
常见的副作用包括腹部肿胀、便秘和腹泻。
©2023美联社。保留所有权利。材料可能不会被出版,广播,重写或重新分配。