CRISPR和单细胞测序确定因果关系的特点和疾病的遗传变异

人类遗传学的主要挑战是理解哪部分基因组驱动特定的特征或导致疾病风险。这个挑战是更大的遗传变异在98%的基因组中发现不编码蛋白质。
纽约大学的研究人员开发的一种新方法和纽约基因组中心结合遗传关联研究,基因编辑单细胞测序为应对这些挑战,发现因果血细胞性状变异和遗传机制。
他们的方法,称为STING-seq和发表在科学、地址直接连接的遗传变异的挑战人类的特征和健康,并能帮助科学家确定药物靶点疾病的遗传基础。
在过去的二十年里,全基因组关联研究(GWAS)已经成为人类基因组研究的一个重要工具。使用,科学家发现了成千上万的基因突变或变异与许多疾病有关,从精神分裂症到糖尿病,以及身高等特征。进行这些研究通过比较大量发现的基因组变异,通常发生在那些与特定疾病或特征。
GWAS可以揭示区域的基因组和潜在变异与疾病或特征。然而,这些协会几乎总是98%的基因组中发现不编码蛋白质,这比被充分研究过的不太好理解2%的基因组编码的蛋白质。进一步的并发症是许多变种被发现在靠近彼此基因组,通过几代人一起旅行,一个概念称为联系。这可能很难区分哪一个变量从其他变异起着真正的因果作用只是附近。即使科学家可以确定哪些变异是造成疾病或特质,他们并不总是知道基因的变异影响。
“人类疾病的研究的主要目标是确定因果基因和变异,从而阐明生物机制并告知为这些疾病的药物靶点,”内维尔说神采,纽约大学生物学副教授,纽约大学的神经学和生理学副教授格罗斯曼医学院的一个核心教员在纽约基因组中心,和研究的文章的第二作者。
“GWAS的巨大成功凸显了提取的挑战疾病生物学见解从这些庞大的数据集。尽管我们所有的努力在过去的10年里,玻璃还只是一半满的最好。说:“我们需要一个新方法•Lappalainen,高级助理教员在纽约基因组中心,基因组学教授k在瑞典皇家理工学院,和研究的文章的第二作者。
治疗镰状细胞性贫血
最近的一项科学突破的治疗镰状细胞性贫血——遗传疾病的发作的pain-illustrates GWAS结合尖端分子工具如基因编辑如何可以识别因果变异,导致创新的治疗方法。使用,科学家们发现的基因组区域重要的生产胎儿血红蛋白基于承诺的目标,扭转镰状细胞性贫血,但他们不知道驱动生产的变体。
研究人员转向CRISPR-a基因编辑工具,使用“DNA分子剪刀削减,”根据GWAS Sanjana-to编辑区域标识。当CRISPR编辑都是在特定的位置附近的非编码基因一个叫做BCL11A基因,它导致高水平的胎儿血红蛋白。
CRISPR现在已经被用于临床试验编辑这个地区骨髓细胞的镰状细胞性贫血患者。修改后的细胞注入到患者后,他们开始生产胎儿血红蛋白,它取代突变成人血红蛋白,有效治疗镰状细胞病。
“这成功的故事在治疗镰状细胞病是一种结果相结合的见解从GWAS基因编辑,“娜说。“但它需要多年的研究只有一个疾病。我们如何规模这个更好地识别因果变异和目标基因从GWAS ?”
GWAS满足CRISPR和单细胞测序
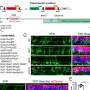
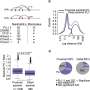
研究小组创建了一个名为STING-seq-Systematic瞄准的工作流和抑制非编码与单细胞测序GWAS位点。STING-seq作品通过biobank-scale GWAS和寻找可能的因果变异使用和监管生化特征元素的组合。研究人员然后使用CRISPR目标的每个地区GWAS,进行单细胞测序的基因组与评估基因和蛋白质表达。
在他们的研究中,研究人员说明使用STING-seq发现目标基因的非编码血液性状的变异。血液特质的百分比血小板,白细胞和血红细胞在血常规检查容易衡量,在GWAS研究。结果,研究人员能够使用GWAS代表近750000人来自不同背景,研究血液特征。
一旦研究人员确定了543个候选区域的基因可能在血液中发挥作用特征,他们使用的一个版本CRISPR叫CRISPR沉默抑制,可以精确的基因组区域。
地区被GWAS CRISPR沉默后,研究人员观察了附近基因的表达在单个细胞特定基因被开启或关闭。如果他们看到一个细胞之间的基因表达差异,变体,没有沉默,他们可以联系具体的目标基因的非编码区域。通过这种方法,研究人员可以确定非编码区域特定的核心特征(,哪些不是),也经常这些非编码区域的细胞通路的工作。
“STING-seq的力量是我们能将这种方法应用到任何疾病或特征,”约翰·莫里斯说,纽约基因组中心的博士后研究员,纽约大学和研究的第一作者。
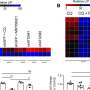
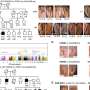
使用STING-seq测试集群的可能变异,看看它们对基因的影响消除了猜测科学家先前遇到当面对连锁基因变异或接近变异,通常但不总是目标基因。在血液特征称为单核细胞计数的情况下,应用CRISPR造成一个基因,CD52,显然是显著改变,而CD52附近感兴趣的变体,它不是最近的基因,因此使用之前的方法可能被忽略了。
在另一个分析,研究人员发现了一个基因称为PTPRC与10血液相关联特征,包括红细胞、白细胞和血小板。然而,有几个GWAS-identified非编码变异在近距离和挑战是了解哪些(如果有的话)可以调节PTPRC表达式。应用STING-seq使他们孤立的变体被看到因果,改变PTPRC表达式。
STING-seq内外
虽然STING-seq可以确定目标基因沉默和因果变异的变异,这并不能解释的方向影响特定的非编码变体将曲柄或减少附近的一个基因的表达。研究人员把他们的方法进一步创建一个互补的方法他们叫beeSTING-seq(基本编辑STING-seq)使用CRISPR准确插入基因变体而不是抑制该地区的基因组。
研究人员设想STING-seq和beeSTING-seq被用来识别因果变异范围广泛的疾病可以治疗基因修改和用于镰状细胞贫血、目标特定基因或细胞通路的药物。
“现在,我们可以连接非编码目标基因变异,这给了我们证据表明小分子或抗体疗法可以开发改变特定基因的表达,”Lappalainen说。
更多信息:约翰·a·莫里斯等,发现目标基因和通路在GWAS汇集单细胞CRISPR位点的屏幕,科学(2023)。DOI: 10.1126 / science.adh7699。www.science.org/doi/10.1126/science.adh7699