研究人员修改药物进入细胞和治疗疼痛

改变一种止吐药物的化学性质使其进入细胞内部隔间,并提供持久的疼痛,根据一项新的研究由纽约大学牙科学院的疼痛研究中心的研究人员。
该研究发表在美国国家科学院院刊》上(PNAS),说明了疼痛信号发生细胞内而不是在表面,强调需要药物,可以达到受体细胞内。
G protein-coupled受体(GPCRs)是一个大家庭的蛋白质调节人体内的许多过程,三分之一的临床使用药物的目标。的一个子集,这些受体在痛苦中扮演着重要的角色,包括neurokinin-1 NK1受体,激活的pain-transmitting神经肽P物质。
几个fda批准的药物目标NK1受体用于防止恶心和呕吐与化疗或手术。科学家先前希望NK1受体是一种很有前途的目标治疗滑坡药物靶向受体未能控制疼痛的临床试验在1990年代和2000年代早期。
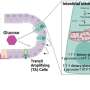
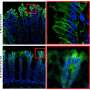
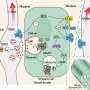
针对NK1受体药物很可能的一个原因没有对疼痛是大多数药物有效阻止在细胞表面的受体。然而,纽约大学疼痛研究中心的研究人员表明GCPRs信号痛苦不是来自细胞的表面,但从车厢内的细胞称为核内体。
“持续信号核内体是必要的痛觉神经元兴奋过度的参与慢性疼痛奈杰尔•Bunnett说:“教授和系主任的分子病理学在纽约大学牙科学院和该研究的资深作者。“因此,治疗疼痛可能需要药物穿透细胞的发展,保留在核内体,并破坏细胞内信号。”
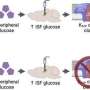
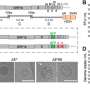
在PNAS研究中,研究人员专注于两种药物,aprepitant和netupitant NK1受体拮抗剂用于防止恶心和呕吐。在实验室里研究NK1受体的临床可用的目标受体的药物,但也有挑战,有大型NK1受体在小鼠和人类之间的区别。为了克服这一点,研究者转基因小鼠表达人类的激肽1受体。
Bunnett和他的同事们曾表明,在纳米颗粒封装aprepitant可以提供核内体阻止疼痛的药物,但是在这项研究中,aprepitant只是短暂的中断endosomal信号在细胞研究和停止疼痛小鼠在短时间内。
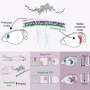
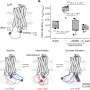
修改第二药物,netupitant,举行更多的承诺。研究人员改变了药物的化学性质,使其更能穿透细胞的脂质膜。他们还改变了电荷的分子在酸性环境中,这样一旦药物进入的酸性环境核内体,它将保持困在和积累。
这些变化允许修改netupitant容易穿透细胞达到核内体和屏蔽信号的激肽1受体在核内体与一个更长期的效应细胞。改变netupitant还有一个更有效和持久的镇痛效应比aprepitant老鼠,netupitant的常规形式。
在另一项实验中,研究人员研究了老鼠的不同类型的激肽1受体细胞的外膜上,而不是在里面。这些老鼠对疼痛比人类NK1受体细胞内,说明核内体的重要性信号疼痛和治疗的需要,可以穿透细胞。
研究人员仍在继续这个研究和其他研究动物模型开发的新疗法疼痛在核内体块GCPRs。
“虽然我们关注neurokinin-1受体,我们的发现有可能适用于许多g蛋白耦合的受体,因为其中许多节目持续的细胞内信号,因此需要药物,可以输入细胞在核内体和阻止受体Bunnett说。
额外的研究的作者包括艾伦•Hegron克洛伊j .桃拉奎尔Tonello Shavonne腾,罗科Latorre,戴恩·d·延森,亚历克斯·r·b·汤姆森和纽约大学牙科学院的布莱恩·l·施密特;菲利普Seemann哈拉尔德许,多罗斯Weikert, Peter Gmeiner Friedrich-Alexander大学埃在德国;和珍妮特Rientjes,尼古拉斯·a·Veldhuis丹尼尔·p·普尔和温迪·l·Imlach澳大利亚莫纳什大学的。
更多信息:Hegron Alan等治疗神经激肽1受体拮抗作用在核内体提供了持续的疼痛缓解,美国国家科学院院刊》上(2023)。DOI: 10.1073 / pnas.2220979120。doi.org/10.1073/pnas.2220979120