抑制自噬和线粒体功能的生物相声底层胰腺导管腺癌
胰腺导管腺癌(PDAC)细胞维持一个高水平的自噬或退化,允许他们在微环境受到了严重的限制。然而,通过这过程自噬促进胰腺癌细胞生长和生存尚未被理解。
发表的一份新报告中科学的进步,Subhadip Mukhopadhyay和一个研究小组放射肿瘤学在纽约大学和哈佛大学和基因组的稳定性,表明自噬改变线粒体功能的抑制PDAC病人。他们实验减毒琥珀酸脱氢酶复杂的铁硫亚基在线粒体铁池限制不稳定的可用性。
癌症细胞系使用自噬维持体内平衡铁形成鲜明对比肿瘤类型这依赖于macropinocytosis。生物学家指出如何提供可利用铁胰腺癌症相关的成纤维细胞癌症细胞抵抗自噬的消融。Mukhopadhyay和同事管理低铁的饮食中小鼠模型阻碍这个相声的形式自噬抑制疗法。结果强调之间的关键联系自噬、铁代谢及线粒体功能驱动胰腺导管腺癌的进展。
铁稳态胰腺导管腺癌(PDAC)
胰腺导管腺癌代表超过95%的胰腺癌高度耐药治疗的5年生存率很低,在癌症相关的死亡人数占到第二个最高水平在美国。这些肿瘤是由一个苛刻,hypoperfused和缺氧微环境改变的营养素。癌细胞能敌对的环境中生存下来通过重组他们的代谢需要依靠营养清除机制如macroautophagy和macropinocytosis生存和成长。以前的工作有突出的作用ferritinophagy——选择性autophagy-and其作用的形式铁内稳态维护。
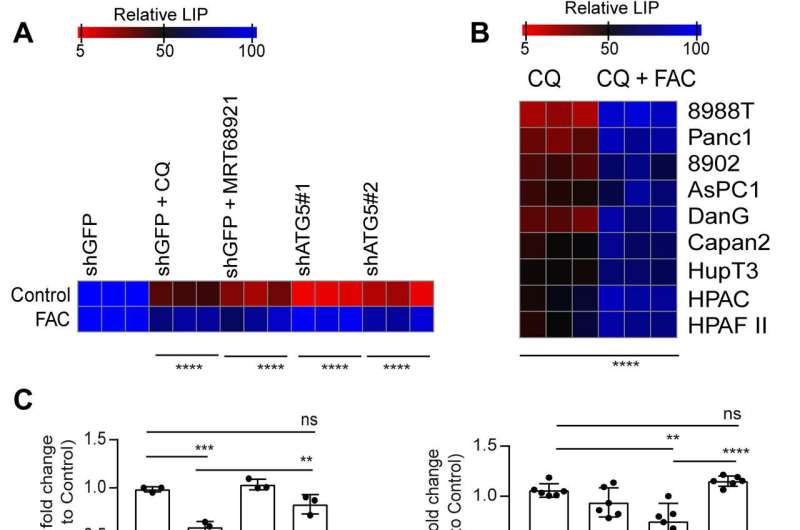
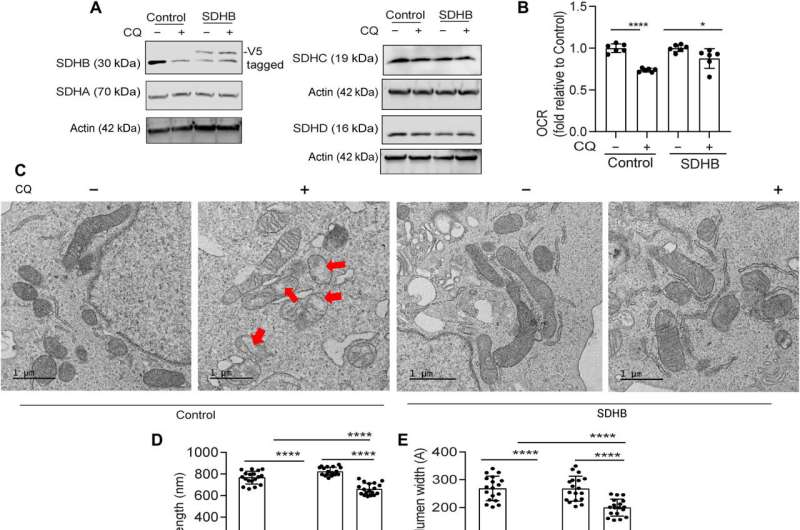
在这工作,Mukhopadhyay和团队表明抑制自噬减少装配iron-sulfur集群稳定不同的蛋白质,包括那些参与电子传递链,如琥珀酸脱氢酶复杂的铁硫B亚基(SDHB)。减少这个分子在胰腺癌细胞自噬导致线粒体的呼吸作用和重组嵴减少微体系结构。补充铁或异位的表达SDHB恢复增长和改善线粒体缺陷。
限制生物铁胰腺韧性癌细胞抑制自噬
此前,Mukhopadhyay和他的同事们展示了自噬抑制胰腺癌癌症细胞系导致线粒体减少耗氧率。然而,他们不能确定这个障碍的机制。之前的研究显示氨基酸池保持不变的自噬抑制,除了降低半胱氨酸的水平。
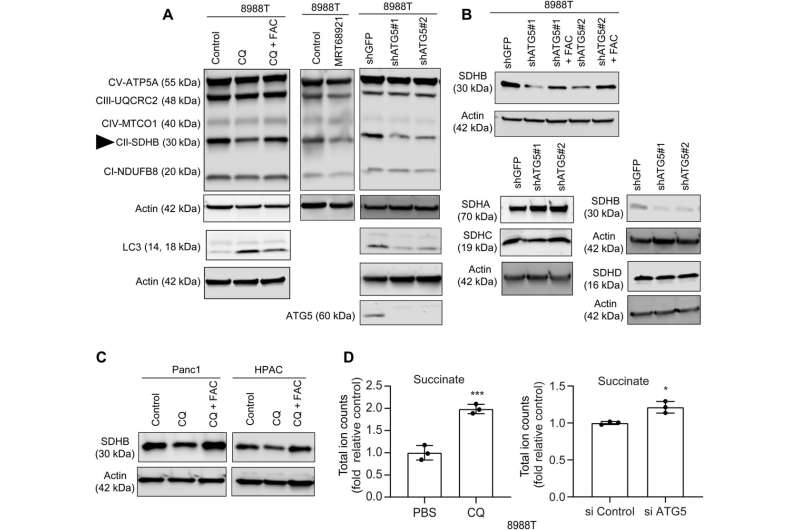
然而,补充半胱氨酸胰腺癌细胞没有改变耗氧量的次品率,表明线粒体途径,直接影响。虽然iron-sulfur集群蛋白质开车线粒体功能,减少不稳定铁池中自噬抑制线粒体呼吸下降后,通过团队的恢复枸橼酸铁铵补充。抑制自噬进一步导致了琥珀酸脱氢酶水平降低复杂的铁硫B亚基(SDHB)蛋白质,强调功能性线粒体蛋白质的损失。
缺陷线粒体结构与自噬抑制相关
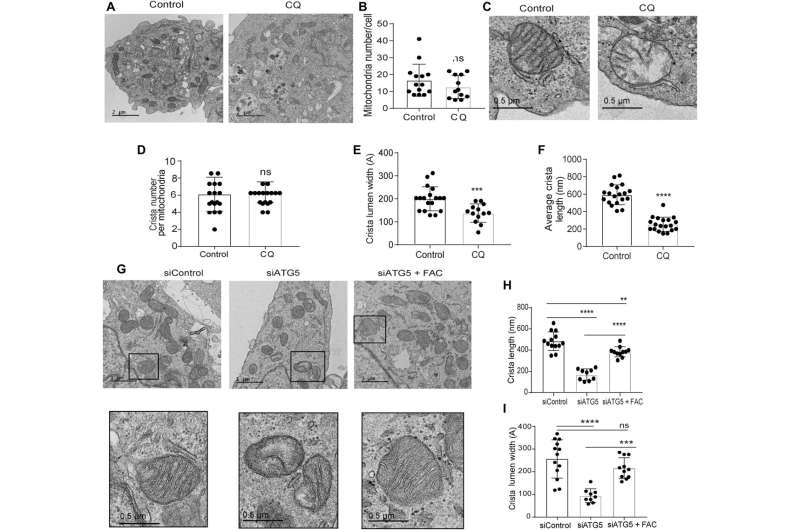
该研究小组使用透射电子显微镜法揭示autophagy-deficient胰腺癌细胞的线粒体结构;通过管理氯喹。他们指出显著减少线粒体嵴与大空腔空间后处理显示功能的缺陷。
团队展示了SDHB蛋白的异位表达可能恢复嵴微体系结构。事实上,过度SDHB救了自噬抑制后的扩散和耗氧率。他们研究了这些组件的机制通过扮演重要角色在铁和硫蛋白质的生物起源,后在胰腺癌细胞自噬的损失。
调查癌症相关的细胞培养与药根之间的串扰
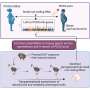
自噬可以调节铁的可用性在胰腺癌细胞,病人反应羟氯喹单一疗法没有临床疾病足以减弱。检查这个抵抗的肿瘤微环境的影响,研究人员研究了补偿的影响不稳定铁池与癌症相关的成纤维细胞共培养胰腺癌细胞重建microphysiological肿瘤环境。
研究人员研究了细胞之间的串扰理解细胞不稳定铁池的监管和检查关键铁转运蛋白的表达。他们指出在成纤维细胞培养与提高出口国ferroprotein autophagy-inhibited胰腺癌细胞。当他们管理叫,他们恢复了自噬抑制的抗增殖作用在癌症细胞系培养系统。
治疗胰腺导管腺癌(PDAC)
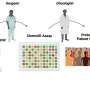
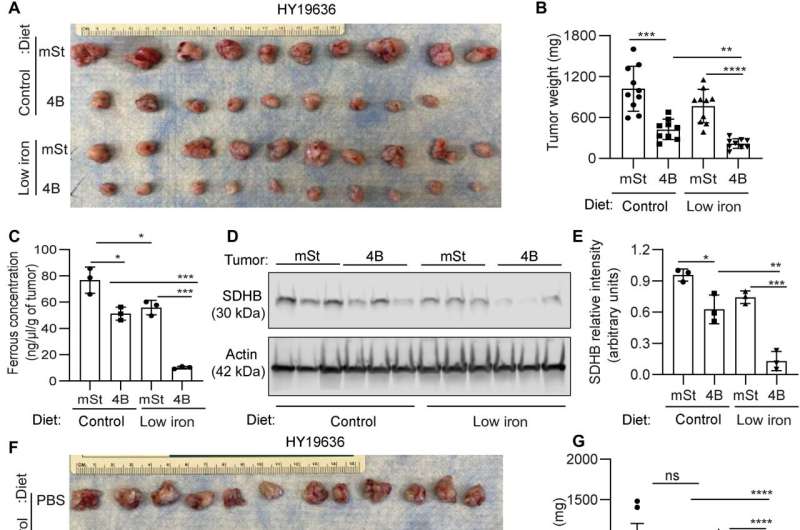
Mukhopadhyay和他的同事们研究治疗癌症的方法,探讨自噬抑制是否能促进铁限制抑制胰腺肿瘤的生长。他们减少可利用铁损害之间的串扰胰腺导管腺癌的细胞和癌症相关成纤维细胞。他们完成这老鼠通过系统地降低铁含量低铁饮食,从而使它们的前两周移植癌细胞了doxycycline-inducible主导向量和鼠标控制向量主机。而饮食中的铁水平并不影响血红蛋白的水平,自噬抑制显著降低肿瘤的生长。低铁饮食进一步降低肿瘤生长表明铁剥夺敏感肿瘤细胞发生自噬抑制。
的组合iron-limiting饮食和自噬在肿瘤生物可利用二价铁浓度,减少,同时减少了琥珀酸脱氢酶复杂的铁硫亚基表达B。当科学家们仅服用氯喹,它未能减少小鼠的肿瘤生长,虽然氯喹和iron-restricted饮食显著降低肿瘤的生长。合并后的数据代表一个低铁饮食一起工作与自噬抑制严重破坏铁在胰腺内稳态导管腺癌肿瘤。
前景
这样,Subhadip Mukhopadhyay和他的同事发现了如何依靠胰腺导管腺癌肿瘤自噬在疾病进展不断发展,随着时间的推移演变。自噬抑制减少不稳定铁池和iron-sulfur集群的合成。他们补充铁的文化和促进iron-sulfur集群和琥珀酸脱氢酶的异位表达复杂的铁硫亚基(SDHB) B蛋白恢复线粒体功能和细胞生长。自噬是基本维持体内平衡铁,和支持线粒体功能所需的生长和扩散,在胰腺癌细胞。
研究人员分析多个代谢之间没有发生肿瘤和间质,和铁代谢的干扰进行了探讨胰腺导管腺癌细胞及其对复杂的肿瘤微环境的影响。这些机械的发现将有助于新的设计方法的发展目标的过程铁在胰腺导管腺癌细胞新陈代谢。
更多信息:Subhadip Mukhopadhyay et al,自噬支持线粒体代谢通过铁稳态的调节在胰腺癌,科学的进步(2023)。DOI: 10.1126 / sciadv.adf9284
Cristovao m·苏萨等胰腺星状细胞通过自噬丙氨酸分泌肿瘤代谢的支持,自然(2016)。DOI: 10.1038 / nature19084
©2023科学BOB体育赌博X网络