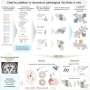
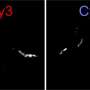
高度不稳定蛋白可能导致神经退行性变的如何

欧洲科学家们复制病理蛋白质总量的主要特性中发现卢伽雷氏症患者的大脑和其他神经系统疾病,洞悉潜在的机制,为新疗法提供有前途的方法。结果发表在自然神经科学。
一些神经退行性疾病,如阿尔茨海默氏症,帕金森氏症,和卢伽雷氏症,又称肌萎缩性脊髓侧索硬化症(ALS),是由蛋白质,误入歧途,开始聚合成纤维,积聚在特定的大脑区域。EPFL)现在,科学家们发现了一种新的机制,解释了总量变得病态和扩散到大脑的不同区域。主要嫌疑人是高度不稳定的蛋白质名为TDP43。科学家们发现TDP43聚集在大脑中形成不含蓄的致病性,直到他们处理透露自己的“粘性”的核心。
聚合的蛋白质TDP43 ALS和其他神经退行性疾病的一个特点。一旦形成,TDP43骨料可以扩散到不同的大脑区域,他们腐败的正常和功能性TDP-43。但首先触发TDP-43聚合什么呢?负责释放其致病作用的机制是什么?这知识差距阻碍了发展的有效药物阻止TDP-43聚合或消除其毒性。
释放的致病效应TDP43乳沟
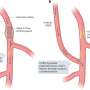
在最近的后续研究与宾夕法尼亚大学的科学家们合作,Senthil Kumar博士和希拉Lashuel教授发现了一种新的机制负责释放TDP43骨料的致病作用,准备在试管或孤立的从后期患者的大脑。这些TDP43骨料的表面必须首先被酶裂解发现隐藏的粘性表面吸引正常TDP-43蛋白质和诱导形成的聚合物。
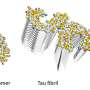
“发现了我们能力开发一个新的纤维的生产方法,在实验室里,这一比例形态和结构特点与ALS患者的大脑,”博士说Senthil t·库马尔,论文的第一作者。

使用低温电子显微镜,样品低温冷冻透过前一个电子显微镜,研究人员表明,TDP-43细丝埋在一个较大的灯丝,难以接近,即,没有病态,因为他们是由球状蛋白质的部分。只要这些细丝埋在这里,他们在隐身模式下,不存在访问其他分子或蛋白质。换句话说,TDP43变得病态时,其外层裂解揭示其“粘性”,内心的细丝,然而仍在隐形模式外涂层完好无损。
“我们的研究结果表明,抑制酶负责裂开TDP-43灯丝代表一个可行的治疗策略减缓TDP-43聚集的形成和防止其蔓延在大脑中,从而减缓疾病的进展。下一步,我们计划识别这些酶和确定抑制他们的活动可以防止TDP-43聚合和神经退行性变的细胞和动物模型的肌萎缩性侧索硬化症,”希拉Lashuel说EPFL教授的实验室领导了这项研究。
新的研究结果对开发新工具和方法也影响ALS和其他的早期诊断神经退行性疾病。保护球状层可以解释为什么TDP-43纤维难以探测。标准方法和染料通常用于检测和监视大脑中的其他蛋白原纤维形成的嫌疑人往往未能发现TDP-43纤维。“这也解释了为什么它一直非常具有挑战性的发展使用完整TDP-43纤维显像剂。这样的显像剂是迫切需要,使早期诊断、监测疾病进展和评估新疗法的疗效,”Kumar博士说。
全身蛋白质研究的重要性
TDP-43是一种高度不稳定的蛋白质并迅速聚集成不同的结构,从而使它具有挑战性的生成pathology-resembling TDP-43聚集在一个可再生的方式。这就迫使许多科学家与小片段的蛋白质,特别是碎片从该地区负责驾驶其聚合。“当我们决定蛋白质片段的结构形式的核心TDP-43纤维准备在实验室里,我们获得了不同结构比TDP-43纤维分离从一个病人的大脑,尽管这些碎片的氨基酸序列几乎是相同的,”Kumar博士说。
“我们的研究结果表明,蛋白质序列侧翼aggregation-prone区域扮演了一个重要的角色在决定最终的结构和复制的属性TDP-43聚集在大脑中需要使用完整的蛋白质,”希拉Lashuel说。“这是必要的,以确保药物、抗体和显像剂在实验室我们开发会有更高的机会参与disease-relevant TDP-43聚集在病人的大脑。”
研究人员表明,他们可以产生TDP-43纤维与纤维的核心序列一样,病人的大脑。“但我们仍然需要确定一览无遗原纤维核心有相同的结构,”希拉尔澄清Lashuel。
“如果我们显示这个,那么我们会有唯一的系统,允许生产实际的病理学在试管中。这将对理解产生巨大影响的病有关的突变和蛋白质的修改影响TDP-43聚合,并将促进开发新药物,阻止TDP-43聚合,中和其致病性或绑定到TDP-43聚集和促进他们的检测大脑中。”
更多信息:Senthil t·库马尔et al,播种TDP-43的聚合需要post-fibrillization蛋白水解乳沟,自然神经科学(2023)。DOI: 10.1038 / s41593 - 023 - 01341 - 4