新的研究显示截断版本的τ蛋白更容易形成粘丝在老年痴呆症患者的大脑
许多神经退行性疾病,包括阿尔茨海默氏症,表现为错综复杂的蛋白质被称为τ纤维。麻省理工学院在一项新的研究中,化学家获得了了解这些纤维形成和确定潜在目标药物,可以形成干扰。
在新的研究中,研究人员发现,一个段的τ蛋白比预期更为灵活,和这种灵活性有助于纤维承担各种不同的形状。他们还显示,这些纤维更容易形成时的两端τ蛋白都砍掉了。
“这种蛋白质解理发生相对在阿尔茨海默病早期,这有助于加快聚集,这是不可取的,“美在香港说,麻省理工学院的教授化学和新研究的资深作者。
研究人员还发现的氨基酸序列似乎帮助τ蛋白在不同的方向弯曲,他们认为能成为一个好目标药物会干扰τ缠结的形成。
麻省理工学院博士后Nadia El Mammeri是该研究的第一作者,发表在7月14日科学的进步。麻省理工学院博士后Pu段和奥雷Dregni也是这篇论文的作者。
原纤维的形成
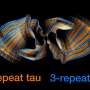
健康的大脑,τ蛋白与微管结合,帮助稳定。蛋白质包含四个重复单元,每个稍有不同,称为R1, R2, R3和R4。在老年痴呆症患者的大脑和其他神经退行性疾病,异常版本的τ形成纤维的细丝,聚集,导致大脑中的神经元纤维缠结。
学习更多关于这些细丝的结构可以帮助研究人员找出异常Tau蛋白质错误折叠,但研究这些细丝很困难,因为他们的固有的无序结构。在这项研究中,研究人员使用核磁共振(NMR)来确定其中的一些结构,使用一个版本的τ蛋白生成在实验室使用DNA重组。
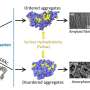
研究人员关注的核心τ蛋白,其中被称为β折叠蛋白质链表创建一个刚性结构。这个核心是对于软盘段。虽然这些软段的具体结构尚不清楚,研究人员使用电子显微镜表明他们组成一个“模糊的外衣”,围绕中央核心。
探索当那些片段丢失,经常发生在阿尔茨海默病,研究者碎掉,然后用NMR分析生成的蛋白质结构。没有这些软盘段,研究人员发现,刚性芯丝更容易形成。这表明,模糊外套有助于防止蛋白质形成细丝,这可能对神经退行性疾病有保护作用。
告诉你“什么是模糊的外套的天然蛋白质实际上具有保护作用。它减慢原纤维形成。一旦你去掉这些部分,然后发生了聚合过程的速度快得多,”洪说。
蛋白质的灵活性
研究人员还发现,R3的重复,占大部分的刚性核心,本身就是非常严格。然而,R2重复,占其余的核心,更灵活,可以产生不同的构象,这取决于环境条件如温度。
“这一发现凸显环境如何影响骨料的形状在原子层面上,类似于变色龙对环境适应它的颜色。温度的微小变化就足以改变整个骨料的形状,通常必须被视为神奇,没有观察到的功能系统,”罗兰·里克•说苏黎世联邦理工学院化学和应用生物科学教授,他并没有参与这项研究。
在不同条件下,R2可以存在直接或铰链部分,研究者显示。他们相信这种构象的灵活性可能占结构上的细微差异,已经出现在τ蛋白中发现不同的疾病,包括阿尔茨海默氏症,corticobasal变性,argyrophilic谷物疾病。
R2内重复,研究人员还发现了六个氨基酸序列似乎比其他R段使结构更加灵活。这个区域可以提供一个可访问的目标药物,抑制τ纤维的形成,香港说。
“这个地区R2是构象上的塑料,所以也许这是一个脆弱的地方,可以通过小分子靶向药物,”她说。“R3地区稳定和刚性,它可能很难分解τ纤维通过专注于那部分。”
研究者们现在打算探索是否可以生成τ结构更紧密地匹配Tau蛋白质的结构从阿尔茨海默氏症患者的大脑和其他神经退行性疾病,通过删除蛋白质在特定的地点或添加化学修饰与这些疾病有关。
更多信息:Nadia El Mammeri et al,τ:淀粉样原纤维结构构象的可塑性第二microtubule-binding重复,科学的进步(2023)。DOI: 10.1126 / sciadv.adh4731
这个故事是由麻省理工学院新闻(再版web.mit.edu/newsoffice/),一个受欢迎的网站,包括麻省理工学院新闻研究、创新和教学。